1、选择题 已知X、Y均为1~18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则两种元素的原子序数之和为 (? )
A.19
B.18
C.27
D.9
参考答案:A
本题解析:根据题意可知,符合条件的是Na2O2和Na2O。所以正确的答案是A。
本题难度:一般
2、选择题 短周期中有X、Y 、Z三种元素,Z可分别与X、Y组成化合物XZ2、ZY2,这三种元素原子的核外电子数之和为30,每个XZ2分子的核外电子总数为38,由此可推知X、Y、Z依次为
A.Na、F、O? B.N、O、P? C.C、F、O? D.C、O、S
参考答案:D
本题解析:三种元素原子的核外电子数之和为30,每个XZ2分子的核外电子总数为38,由此可知,Z的原子序数和Y的原子序数之差是8,即二者是同主族元素,所以符合条件的只有选项D,答案选D。
点评:该题是中等难度的试题,试题设计新颖,灵活性强。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
3、填空题 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置?。
(2)A元素与水反应的离子方程式是? ?。
?。
(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式? ?。
?。
(4)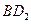 和
和 均具有漂白性,二者的漂白原理?。(填“相同”或“不同”)
均具有漂白性,二者的漂白原理?。(填“相同”或“不同”)
(5)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
3H2+N 2
2 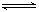 ?2NH3△H=-92.4kJ·mol-1
?2NH3△H=-92.4kJ·mol-1
①当合成氨反应达到平衡后,改变某一外界条件 (不
改变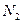 、
、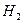 和
和 的量),反应速率与时间的关
的量),反应速率与时间的关
系如右图所示。图中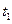 时引起平衡移动的条件可能
时引起平衡移动的条件可能
是?,其中表示平衡混合物中 的含量最
的含量最
高的一段时间是?。
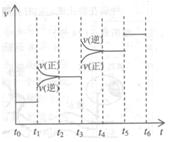
②温度为T℃时,将2a mol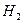 和a mol
和a mol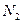 放入0.5 L?密闭容器中,充分反应后测得
放入0.5 L?密闭容器中,充分反应后测得 的转化率为50%。则该反应的平衡常数为?。
的转化率为50%。则该反应的平衡常数为?。
参考答案:(1)第三周期,第VIIA族?(2) 2Na+2H2O=2Na++2OH-+H2↑
(3) Cl2+Na2S=2NaCl+S↓?(4)不同?(5)加压? t2-t3? 4/a2
本题解析:略
本题难度:一般
4、填空题 X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期原子半径最大的元素,N是地壳中含量最高的金属元素。
用化学用语回答下列问题:
(1) M在元素周期表中的位置为?;六种元素的原子半径从大到小的顺序是?
(2)Z、X两元素按原子数目比l∶3构成分子A, A的电子式为?,Y、L两元素按原子数目比l∶2构成分子B,B中所含的化学键类型为?。
(3)硒(se)是人体必需的微量元素,已知非金属性:34Se<L。请结合原子结构解释原因?。
(4)用Y、L、M构成的正盐溶液可以清除油污,请结合离子方程式以及必要的文字解释原因?。
(5)用石墨作电极,NCl3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出电解熔融Q制取N的电极方程式:阳极:?;阴极:?。
参考答案:(1)第三周期、第ⅠA族(1分);Na>Al>C>N>O>H(2分)
(2)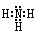 (1分),极性共价键(1分)
(1分),极性共价键(1分)
(3)O和Se同族,原子半径依次增大,导致得电子能力减弱,所以非金属性减弱。(2分)
(4) CO32- + H2O  ?HCO3- +OH-,碳酸钠溶液水解显碱性,促使油脂在碱性条件下水解从而溶解。(2分)
?HCO3- +OH-,碳酸钠溶液水解显碱性,促使油脂在碱性条件下水解从而溶解。(2分)
(5)2O2--4e-=O2↑(2分),Al3+ +3e-=Al(2分)
本题解析:(1)原子半径主要由电子层数、核电荷数决定,同周期元素电子层数相同,原子半径由核电荷数决定,核电荷数越小,半径越大,所以M短周期原子半径最大的元素是Na,位于元素周期表的第三周期第一主族;构成蛋白质的基础元素X、Y、Z、L分别是H、C、N、O,地壳中含量最多的金属元素是Al,所以N是Al元素,六种元素的原子半径从大到小的顺序为Na>Al>C>N>O>H
(2)Z、X两元素按原子数目比l∶3构成分子A,A是NH3,其电子式为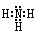 ? Y、L两元素按原子数目比l∶2构成分子B,B为CO2,CO2中所含的化学键类型为极性共价键;
? Y、L两元素按原子数目比l∶2构成分子B,B为CO2,CO2中所含的化学键类型为极性共价键;
(3)O、Se是同主族元素,从上到下随原子半径逐渐增大,元素原子得电子的能力减弱,所以非金属性减弱
(4)用Y、L、M构成的正盐溶液为碳酸钠溶液,CO32-水解CO32- + H2O 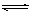 ?HCO3- +OH-,使溶液显碱性,促使油脂在碱性条件下水解从而溶解
?HCO3- +OH-,使溶液显碱性,促使油脂在碱性条件下水解从而溶解
(5)用石墨作电极,电解AlCl3溶液,和电解食盐水类似,得到Al(OH)3,Al(OH)3受热分解生成化合物QAl2O3,电解熔融Al2O3时,阳极是O2-放电,产生氧气,电极反应方程式是2O2--4e-=O2↑,阴极是Al3+放电,电极方程式为Al3+ +3e-=Al
本题难度:一般
5、选择题 已知:①硫酸比次氯酸稳定②硫酸的酸性弱于高氯酸③H2S 比HCl易被氧化④HCl比 H2S更容易由单质合成⑤盐酸的酸性比氢硫酸(H2S)强。⑥硫不溶于水,而氯气溶于水⑦通常状态下硫为淡黄色晶体,而氯气为黄绿色气体⑧在与金属形成的化合物中硫为-2价,而氯为-1价⑨在跟同一金属(如Cu或Fe)反应时,金属被硫氧化成低价态,被氯氧化成高价态。上述事实能说明硫的非金属性比氯弱的是
A.②③④⑨
B.③④⑤⑦⑧⑨
C.②③④⑧⑨
D.①③⑤⑧
参考答案:A
本题解析:略
本题难度:一般