|
高考化学知识点总结《铁的氧化物》高频试题强化练习(2019年最新版)(十)
2019-07-04 00:59:43
【 大 中 小】
|
1、填空题 (Ⅰ)将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑。再在酒精灯上将该铜丝加热至红热状态。 如右图所示,趁热插入到试管里的氯化铵晶体中,在试管中出现白烟。冷却后取出铜丝,可看到铜丝变成光亮的紫红色。回答下列问题:
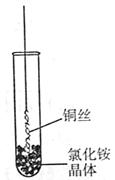
⑴解释“当红热的铜丝插入氯化铵晶体中,出现白烟”的原因(用化学方程式表示)?。
⑵灼热的氧化铜在氯化铵中变成单质铜,写出该反应的化学方程式?
?。
( II)2008年,我国的航天事业取得了巨大的成就,航天员翟志刚顺利实现了太空行走。在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴N2H4·H2O能发生类似NH3·H2O的微弱电离,使溶液显示弱碱性,该电离分两步,写出第一步电离的方程式?。
⑵在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是?(填序号字母)。
A.酒精灯
B.长直玻璃导管
C.锥形瓶
D.冷凝管
| E.牛角管(接液管)? F.蒸馏烧瓶? G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是?。
⑶肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,每生成1molFe3O4,需要消耗肼的质量为??g。
参考答案:(Ⅰ) ⑴NH4Cl NH3↑+HCl↑? NH3+HCl=NH4Cl?(1,1) NH3↑+HCl↑? NH3+HCl=NH4Cl?(1,1)
⑵2NH3+3CuO 3Cu+N2↑+3H2O或 2NH4CI+3CuO 3Cu+N2↑+3H2O或 2NH4CI+3CuO N2↑+3Cu+3H2O+2HCl?(1) N2↑+3Cu+3H2O+2HCl?(1)
(Ⅱ)?⑴N2H4·H2O N2H5++OH-?⑵ ①BG? ②温度计?⑶8g?(1,1,1,1) N2H5++OH-?⑵ ①BG? ②温度计?⑶8g?(1,1,1,1)
本题解析:略
本题难度:一般
2、实验题 (16分)铜与浓硫酸反应,实验装置如图所示。
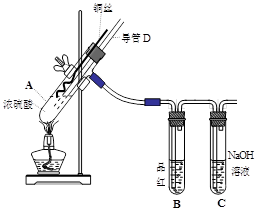
(1) 装置A中发生反应的化学方程式为:?,反应过程中试管B中的现象是?,试管C的作用是?。
(2) 导管D的下端(虚线段)应位于?(液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;②?。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
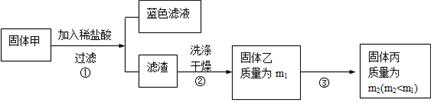 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:?。 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:?。
(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为?。
(5)结论:甲中有CuO,还肯定含有的物质是?。
参考答案:33.(16分)(1)Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O (2分)、品红溶液褪色(2分)、吸收多余的SO2,防止污染空气(2分)
(2)液面下;防倒吸 (4分)
(3)泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分)
(4)2Cu+O2△2CuO (2分)
(5)CuS(2分)
本题解析: (1) 该实验研究的是铜与浓硫酸的反应,因此在A装置中发生的反应方程式为Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O。反应中有SO2生成,因此B中的品红溶液被漂白褪色,C试管起到吸收过量SO2的目的,防止SO2污染空气。
(2) 由于A装置是制备SO2的发生装置,所以导管D的下端必须插入溶液中,才能防止产生的SO2不会从导管D中逸出来;而导管D的作用是在实验结束后用于排除A装置的SO2,同时能够平衡A和B中气压,防止B中液体倒吸。具体操作就是把D下端从溶液中提起。
(3) 煅烧的实验用具必须使用耐高温的坩埚,而与坩埚配套使用的还有泥三角、坩埚钳等。
(4)根据题中的判断,该固体甲可能是CuO、Cu2O、CuS、Cu2S,因此用稀盐酸溶解,根据已知的反应,反应得到的固体乙可能是Cu、CuS、Cu2S,对固体乙进行煅烧,因此除了已知的几个煅烧反应外,还可能发生的反应为单质铜的煅烧2Cu+O2△2CuO。
(5) 根据(4)的分析,利用反应的方程式对各种成分煅烧结果进行推断分析,若Cu煅烧,煅烧生成CuO使质量增重;若CuS煅烧,煅烧产生CuO使质量减小;若Cu2S煅烧,煅烧生成CuO是质量不变。因此要满足流程中煅烧前后质量减小,则固体中必须还含有能使煅烧前后质量减小的CuS。
本题难度:一般
3、选择题 下列关于铁及其化合物的说法中正确的是
A.Fe3O4是—种红棕色粉末,俗称磁性氧化铁
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.去除FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤
D.Fe3+与KSCN反应产生红色沉淀
参考答案:C
本题解析:A. Fe3O4是—种黑色晶体,俗称磁性氧化铁。? B.铁与水蒸气在高温下的反应产物为Fe3O4和H2。D.Fe3+与KSCN反应产生红色溶液;所以,ABD错误。
本题难度:一般
4、选择题 把铜粉和铁粉的混合物,放入一定量的稀硝酸中,微热,反应完毕发现铜有剩余,则溶液中含有的阳离子是?
A.Cu2+、Fe2+
B.Cu2+、Fe2+、Fe3+
C.Cu2+、Fe3+
D.Fe3+
参考答案:A
本题解析:铜有剩余,说明硝酸已经反应完,可能发生的反应有:
Fe+4H++NO3-====Fe3++NO↑+2H2O
3Cu+8H++2NO3-====3Cu2++2NO↑+4H2O
Fe+2Fe3+====3Fe2+
Cu+2Fe3+====2Fe2++Cu2+
从反应可知,当铜有剩余,溶液中Fe3+已消耗尽,铜跟Fe2+不能反应,所以溶液中的阳离子有Cu2+、Fe2+,选A。
本题难度:一般
5、实验题 Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为?;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式:?。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
实验步骤
| 预期现象与结论
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。
| ?
?;
| 步骤2:____________________________________
____________________________________。
| ?
|
?
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水,?。
参考答案:(1)2Fe2++Cl2=2Fe3++Cl-(3分) 2I-+Cl2=I2+2Cl-?(3分)
(2)(6分,各2分)
实验步骤
步骤1:…………………………………………
预期现象与结论
溶液变成黄色
步骤2:向试管中继续滴加几滴20%KSCN溶液
或:向试管中继续滴加几滴淀粉溶液
溶液不变血红色,证明I-的还原性强于Fe2+
或:溶液变蓝色,证明I-的还原性强于Fe2+
?
(3)滴加几滴20%KSCN溶液,无明显现象;再加入过量3%H2O2,溶液变血红色。(4分)
本题解析:(1)硫酸亚铁中滴加强化性的氯水,亚铁离子被氧化为铁离子,所以发生溶液变色,所以离子方程式为2Fe2++Cl2=2Fe3++Cl-?;而往碘化钾溶液中同样滴加氯水,还原性的I-被氧化成碘单质,形成棕黄色的碘水溶液,所以离子方程式为2I-+Cl2=I2+2Cl-。
(2)本探究实验的目的是以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+ 。要证明I-的还原性强于Fe2+ ,则可以设计让I-和Fe2+ 混合,然后滴加少量的强氧化剂,根据氧化还原规律,还原性强的先被氧化,所以滴加氯水试剂,只要证明先反应生成碘单质,而没有铁离子生成,即可得到结论。所以具体实验情况如下表:
实验步骤
步骤1:…………………………………………
预期现象与结论
溶液变成黄色
步骤2:向试管中继续滴加几滴20%KSCN溶液
或:向试管中继续滴加几滴淀粉溶液
溶液不变血红色,证明I-的还原性强于Fe2+
或:溶液变蓝色,证明I-的还原性强于Fe2+
?
(3)要证明碘与铁的化合物中铁显+2价,实质上就是利用(2)中提供的20%KSCN试剂来检验亚铁离子,所以正确的操作是:取少量样品溶于水,滴加几滴20%KSCN溶液,无明显现象;再加入过量3%H2O2,溶液变血红色,说明碘与铁的化合物中铁显+2价。
本题难度:一般
|  (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:?。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:?。