|
高考化学知识点总结《铁的氧化物》高频试题强化练习(2019年最新版)(二)
2019-07-04 00:59:43
【 大 中 小】
|
1、计算题 (4分)将4.42 g复盐CuSO4·x(NH4)2SO4·y H2O加到过量NaOH溶液中,加热,生成的气体用100 mL 1 mol·L-1H2SO4吸收,多余的H2SO4用80 mL 2 mol·L-1NaOH恰好完全中和,另取等质量的复盐溶于水后与足量BaCl2溶液反应,生成6.99 g沉淀,求x、y的值。
参考答案:x=2,y=1。
本题解析:n(BaSO4)="0.03" mol,n(H+)="0.2" mol,与NH3反应的H+的物质的量为:0.2 mol-0.08 L×2 mol·L-1="0.04" mol? n(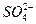 )="0.03" mol; )="0.03" mol;
所以n (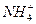 ): n ( ): n (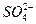 )=0.04∶0.03=4∶3? 2x∶(x+1)=4∶3? x=2 )=0.04∶0.03=4∶3? 2x∶(x+1)=4∶3? x=2
又因为:M(复盐)="4.42" g÷0.01 mol="442" g·mol-1,所以y=1。
本题难度:一般
2、实验题 [2012·漳州质检](11分)某研究学习小组为探究Fe3+离子是否能氧化SO2,设计了如下的实验装置(假设实验中所用装置的气密性良好)。
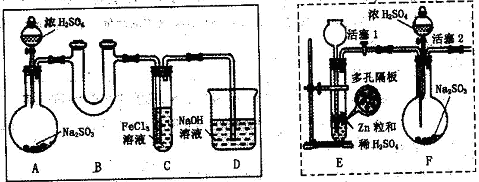 ? ?
(1)甲同学利用以上实线框内装置制取SO2并进行探究实验。
①装置A中发生反应的化学方程式为?。
②装置B的作用是?。
③反应一段时间后,甲同学取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液观察到有白色沉淀产生。由此他得出结论:Fe3+可氧化SO2。
(2)乙同学认为甲同学的实验不严谨,他用以上虚线框内装置替代装置A,先使装置E内试剂反应一段时间后,关闭活塞1,打开活塞2,又反应片刻后,取装置C中少量溶液,往其中加入酸性KMnO4溶液,观察到KMnO4溶液紫红色褪去。由此他得出结论:Fe3+已被SO2还原成Fe2+。
①该实验制H2时需用浓硫酸配制450mL3mol/L的稀硫酸,配制中所需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需?。
配制过程中若其它操作无误,但没有洗涤烧杯与玻璃棒,则所配制溶液的浓度会??(填“偏高”、“偏低”或“无影响”)。
②在该实验过程中H2所起得作用是?。
(3)丙同学认为甲、乙的实验均不严谨,为此他沿用乙同学的实验装置及操作,重新实验。待装置F内反应一段时间后,取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液,得出与甲同学相同的结论。请你分析回答:
①甲同学实验不严谨的原因是?。(选填序号)
A.SO2溶解量太小
B.SO2不与Fe3+发生反应
C.H2SO3与BaCl2不反应
D.装置中的空气与SO2进入水中也可生成H2SO4
| ②乙同学的实验结论不严谨的原因是?。
参考答案:(11分)(1)①Na2SO3+H2SO4=Na2SO4+SO2↑+H2O?②防倒吸
(2)①500mL容量瓶(无型号不得分)?偏低?②排尽装置中的空气
(3)①D?②SO2也能使高锰酸钾溶液褪色
本题解析:(1)①硫酸的酸性强于亚硫酸,硫酸与亚硫酸反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。②装置B的作用显然是防止倒吸。
(2)①要配制450mL3mol/L的稀硫酸,由于实验室中无450mL的容量瓶,故应选用500mL的容量瓶;配制过程中未洗涤烧杯与玻璃棒,会造成溶质损失,致使所配溶液浓度偏低。②乙同学用H2排尽装置中的空气,以防止发生反应SO2+H2O+O2=H2SO4。
(3)①乙同学设计用H2排尽装置中的空气来改进甲同学的实验,正是对甲同学实验不严谨的改进,因为SO2溶于水生成H2SO3,装置中的O2会把H2SO3氧化成H2SO4。
②丙同学对乙同学实验的改进也正是乙同学实验不够严谨之处,因为Fe2+能使KMnO4溶液褪色,SO2也能使KMnO4溶液褪色。
本题难度:一般
3、选择题 把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是(?)
A.H+?B. Cu2+?C.Fe3+? D. Fe2+
参考答案:D
本题解析:
正确答案:D
Fe+2Fe3+=3Fe2+? Fe+Cu2+=Fe2++Cu ,所以溶液中最多的阳离子是Fe2+ .
本题难度:简单
4、填空题 (4分)有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为?;
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为?;
参考答案: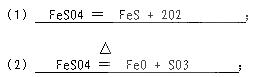
本题解析:略
本题难度:一般
5、填空题 利用废的生铁丝(表面有铁锈)、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下图:
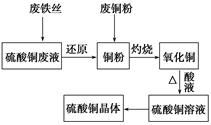
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是__________________,可能发生反应的离子方程式有Fe+2H+=Fe2++H2↑、_____________________、__________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO未被还原。还原剂是_______________。
(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h。请回答下列问题:
①反应时温度必须控制在50~60℃,温度不宜过高,这样操作的目的_____;
②写出反应的化学方程式:_____________、________________________________。
(4)由硫酸铜溶液得到硫酸铜晶体的实验操作为________________________。
(5)直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是_________________。
参考答案:
(1)除去铁丝表面的氧化物(2分)Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,(各3分)
(2)C或CO(2分)(3)①防止双氧水分解(2分)②CuO+H2SO4=CuSO4+H2O,(3分)
Cu+H2O2+H2SO4=CuSO4+2H2O(3分)(4)蒸发浓缩、冷却结晶(2分)
(5)生成等量的硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2(2分)
本题解析:铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,是为了除去铁丝表面的氧化物发生反应的离子反应有Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:①灼烧不充分Cu未被完全氧化。②CuO未被充分还原。所用还原剂应该是C、CO。(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h。反应时温度必须控制在50~60℃,温度不宜过高是为了防止高温时双氧水分解,发生的反应为:CuO+H2SO4=CuSO4+H2O,Cu+H2O2+H2SO4=CuSO4+2H2O(4)硫酸铜为强酸弱碱盐,由于硫酸没有挥发性,所以将溶液蒸发浓缩后,利用硫酸铜的溶解度受温度的影响变化较大。随温度的升高而增大,随温度的降低而减小。用冷却结晶法使其析出。(5)若采用直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,得到硫酸铜,因为发生反应Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,由于一部分硫酸反应生成了二氧化硫气体污染大气,所以比稀硫酸与氧化铜反应消耗的硫酸多,故在实际操作中较少。
本题难度:一般
|