1、选择题 常温常压下,将一定质量的Fe、Fe2O3、Fe3O4的混合物平均分成两份,一份溶于足量稀硝酸中恰好完全反应,生成0.1 mol NO气体, 将另一份溶于足量稀盐酸中生成一定量气体,向两次反应后溶液中加入硫氰化钾溶液,溶液颜色均无明显变化,则固体溶于盐酸后生成气体的体积为(?)
A.2240mL
B.3360mL
C.3675mL
D.4480mL
参考答案:C
本题解析:根据题意可知,反应后的溶液是含有Fe2+的溶液。硝酸与Fe、Fe2O3、Fe3O4的混合物反应产生Fe(NO3)2、NO、H2O。Fe、Fe2O3、Fe3O4的混合物与元素反应产生FeCl2、H2、H2O。假设每一等分含有Fe、Fe2O3、Fe3O4的物质的量分别是a、b、c,则根据电子守恒可得2a=2b+2c+0.1×3;假设产生的氢气的物质的量为x,在另一份中的电子守恒是:2a=2b+2c+2x。2x=0.3.所以x=0.15mol。该气体在标准状况下体积是V=n·Vm=0.15mol×22.4L/mol=3.36L=3360ml,若在常温下,因为温度高于标准状况,所以气体摩尔体积比22.4L/mol略大,所以放出的气体的体积就比3360ml稍微大些,只有C符合题意。故选项是C。
本题难度:一般
2、选择题 下列物质的名称和化学式不相符的是
[? ]
A.磁铁矿(FeO)
B.铝土矿(Al2O3)
C.铁红(Fe2O3)
D.赤铁矿(Fe2O3)
参考答案:A
本题解析:
本题难度:简单
3、填空题 (9分) 高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过NaClO氧化法制备Na2FeO4,生产过程如下:
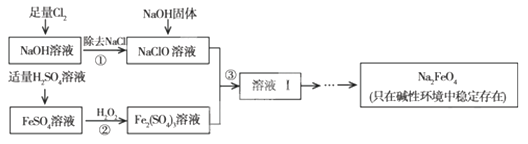
回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是____?_____________________________
(2)步骤②反应的离子方程式是_____? _____
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为___?
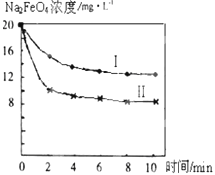
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH____(填“高”或“低”)。
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比Cl2的_____(“高”或“低”),用Na2FeO4代替Cl2作净水消毒剂的优点是____?(答出两点即可)
参考答案:(9分) (1)Na2FeO4只在碱性环境中稳定存在
(2)2Fe2++H2O2+2H+=2Fe3++2H2O? (3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
(4)高? (5)低?既能杀菌消毒又能净水(或无毒或方便保存等)
本题解析:(1)由于Na2FeO4只在碱性环境中稳定存在,所以必须加入氢氧化钠以生成Na2FeO4。
(2)双氧水具有氧化性,能氧化亚铁离子,反应的方程式是2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)根据主要的反应物和生成物可知,该反应的方程式是2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O。
(4)由于Na2FeO4只在碱性环境中稳定存在,所以溶液的碱性越强,Na2FeO4的含量越高,因此根据图像可知,曲线I比曲线II对应的污水pH高。
(5)Na2FeO4的消毒效率是166÷3=55.33,氯气的消毒效率是71÷2=35.5,所以Na2FeO4的消毒效率(以单位质量得到的电子数表示)比Cl2的低。Na2FeO4能杀菌消毒,且其还原产物是铁离子,而铁离子能水解生成氢氧化铁胶体,能吸附溶液中的悬浮物。
点评:化学工艺流程题是近年来高考中备受关注的题型,这类试题的文字量大、信息新颖、情境陌生,涉及的知识点多,综合性强,不少考生感到解题困难。本文就这类试题的特点、类型和解题策略等问题略加分析,以帮助考生轻松应对。一、化学工艺流程题的特点及作用化学工艺流程题有以下三个方面的特点和作用:一是试题源于生产实际,以解决化学实际问题为思路进行设问,使问题情境真实,能培养学生理论联系实际、学以致用的学习观;二是试题的内容丰富,可以涉及化学基础知识的方方面面,能有效考查考生对基础知识的掌握情况和应用基础知识解决实际问题的迁移推理能力;二是试题背景鲜活,题干一般较长,阅读量大,能考查考生的阅读能力和对资料的加工处理能力。二、化学工艺流程题的解题思路及方法化学工艺流程题的结构通常分为题头、流程图和问题三部分。题头一般是简单介绍该工艺生产的原材料和工艺生产的目的(包括副产品),流程图部分主要用框图形式将原料到产品的主要生产工艺流程表示出来,问题部分主要是根据生产过程中涉及的化学知识设计系列问题。
本题难度:一般
4、选择题 下列铁的合金中,含碳量最高的是
A.生铁
B.高碳钢
C.低碳钢
D.不锈钢
参考答案:A
本题解析:
本题难度:简单
5、实验题 某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式_____________________________________。
(3)检验沉淀已经洗涤干净的操作及现象是_____________________。
(4)坩埚质量为W1 g,加热后坩埚与红棕色固体总质量为W2 g,则样品中铁元素的质量分数是________ (列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________________________________________________
(写出一种原因即可)。
参考答案:(1)100 mL容量瓶、胶头滴管
(2)2Fe2++Cl2=2Fe3++2Cl-
(3)取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
(4) ×100% 固体加热时未充分反应变为Fe2O3
×100% 固体加热时未充分反应变为Fe2O3
本题解析:(1)配制100 mL溶液,需用100 mL容量瓶,定容时使用胶头滴管;(2)氯气有强氧化性,能把二价铁离子氧化生成三价铁离子同时生成氯离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl-。(3)检验沉淀已洗涤干净时,取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;(4)红棕色固体是氧化铁,其质量是W2 g-W1 g,其中铁元素的质量是 g,样品中铁元素的质量分数是
g,样品中铁元素的质量分数是 ×100%;固体加热时未充分反应变为Fe2O3会导致测量结果偏大。
×100%;固体加热时未充分反应变为Fe2O3会导致测量结果偏大。
本题难度:一般