1、计算题 锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有??(任写一种方法)。碳酸锶与盐酸反应的离子方程式为?。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为?。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水? B.氢氧化钠? C. 氢氧化锶粉末? D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和??(填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是??。
A.50~60℃? B.70~80℃? C.80~100℃?D.100℃以上?
(5)若滤液中Ba2+?浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于?mol/L。
?
| SrSO4
| BaSO4
| Sr(OH)2
|
Ksp
| 3.3×10—7
| 1.1×10—10
| 3.2×10—4
|
?
参考答案:(16分)
(1)(共5分)升高温度、或增大盐酸浓度、或充分搅拌等(合理均可,2分)?
SrCO3+2H+=Sr2++CO2↑+H2O (3分)
(2)(共3分)2Fe2++H2O2+2H+=2Fe3++2H2O?
(3)(共4分)C(2分)? BaSO4(2分)?
(4)(共2分) A?
(5)(共2分)0.03(或3×10-2)
[计算过程:c(SO42-)=1.1×10-10÷10-5 mol?L-1=1.1×10-5 mol?L-1,c(Sr2+)=3.3×10-7÷1.1×10-5 mol?L-1=3×10-2 mol?L-1]
本题解析:(1)根据影响化学反应速率的因素,升高温度、或增大盐酸浓度、或充分搅拌等都能加快反应速率;盐酸的酸性比碳酸强,因此碳酸锶与盐酸能发生复分解反应,同主族元素具有相似性,镁、钙、锶、钡都是第IIA族,碳酸镁微溶、碳酸钙难溶、碳酸钡难溶,由此推断碳酸锶难溶于水,应保留化学式,则该反应为SrCO3+2H+=Sr2++CO2↑+H2O;
(2)铁的化合物溶于盐酸时可能生成亚铁离子和铁离子,双氧水具有强氧化性,是绿色氧化剂,可以将亚铁离子氧化为铁离子,即2Fe2++H2O2+2H+=2Fe3++H2O,便于除铁;
(3)氨水与氢离子容易结合成铵根离子,虽然能消耗氢离子,升高溶液的pH,但是引入的铵根离子是新的杂质,故A选项错误;氢氧化钠也能消耗氢离子,达到调节溶液pH的目的,但是引入的钠离子是新的杂质,故B选项错误;氢氧化锶能消耗氢离子,将溶液pH调至8~10,且引入的锶离子是目标产物需要的离子,故C选项正确;碳酸钠能消耗氢离子,但是会引入钠离子,故D选项错误;由于钡的化合物溶于盐酸产生钡离子,加入过量硫酸时,硫酸根离子与钡离子结合生成硫酸钡沉淀,则滤渣的主要成分是氢氧化铁和硫酸钡;
(4)由于SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水,为了减少目标产物的损失,不能使温度达到61℃或61℃以上,故只有A选项正确;
(5)由于BaSO4(s) Ba2++SO42—,Ksp(BaSO4)=c(Ba2+)?c(SO42—),则滤液中c(SO42—)= 1.1×10—10÷1×10-5 mol/L =1.1×10—5mol/L,由于SrSO4(s)
Ba2++SO42—,Ksp(BaSO4)=c(Ba2+)?c(SO42—),则滤液中c(SO42—)= 1.1×10—10÷1×10-5 mol/L =1.1×10—5mol/L,由于SrSO4(s) Ba2++SO42—,为了防止锶离子沉淀,则Qc(SrSO4)=c(Sr2+)?c(SO42—)≤Ksp(SrSO4),则滤液中c(Sr2+)≤3.3×10—7÷1.1×10-5 mol/L =3.0×10—2mol/L。
Ba2++SO42—,为了防止锶离子沉淀,则Qc(SrSO4)=c(Sr2+)?c(SO42—)≤Ksp(SrSO4),则滤液中c(Sr2+)≤3.3×10—7÷1.1×10-5 mol/L =3.0×10—2mol/L。
本题难度:困难
2、选择题 下列物质的转化,不能通过一步反应完成的是( )
A.Na2CO3→Na2SiO3
B.SiO2→H2SiO3
C.KBr→KCl
D.SiO2→Si
参考答案:B
本题解析:
本题难度:简单
3、选择题 根据海水综合利用的工业流程图(如图),判断下列说法正确的是(? )
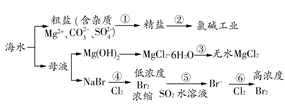
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2 mol Br-,需消耗2.24 L Cl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
参考答案:D
本题解析:过程①是粗盐的精制,其中除去可溶性杂质离子的过程为化学过程,A错;过程③中若将MgCl2·6H2O灼烧,得到MgO,B错;过程④、⑥反应中每氧化0.2 mol Br-,需消耗标准状况下2.24 L Cl2,题中未指明气体的状态,C错;过程⑤的反应为SO2+Br2+2H2O=H2SO4+2HBr,溶液显强酸性,D对。
本题难度:一般
4、选择题 “白色污染”是环保治理的一个重要方面,“白色污染”是指工业或生活中排放或废弃的(?)
A.工业废气
B.工业废水
C.矿渣
D.塑料
参考答案:D
本题解析:“白色污染”是指工业或生活中排放或废弃的塑料。
本题难度:简单
5、填空题 (12分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备 CuSO4·5H2O及纳米材料G,主要步骤如下:

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2 +生成沉淀的pH 分别如下:
物质
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe(OH)3
| 2.2
| 3.2
|
Fe(OH)2
| 7.6
| 9.6
|
Cu(OH)2
| 4.7
| 6.4
|
请回答下列问题:
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]______(填“>”或“<”)Ksp[Cu(OH)2]。
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,目的是氧化_____________(填离子符号)。该工厂选用试剂①最好为下列中的?(填代号)。
a.? Na2O2 ?b. H2O2? c. Cl2? d. KSCN
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在_______℃,pH控制在________,氧化时间为________小时左右。

(4)向溶液B中加入试剂②的化学式为_______,操作Ⅰ的名称是_________。
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为_____________________________________________。取A溶液20.00 mL,用去0.0240 mol/L KMnO4溶液16.00 mL时恰好达到滴定终点,则A溶液中Fe2+浓度为?。
参考答案:(12分)⑴? >(1分)?(2) Fe2+ (1分)b (1分)
(3) 80? 1.5? 4 (3分)?(4)CuO(1分)?过滤(1分)
(5)MnO4-+5Fe2++8H+=Mn2++ 5 Fe3++4H2O?(2分) 0.096mol/L (2分)
本题解析:
(1)由表格数据可看出,Cu2+、Fe2+开始沉淀的PH分别为4.7、7.6,即Cu2+所需OH—的浓度小,由Ksp定义式可知Ksp[Cu(OH)2]相对较小。
(2)要制备硫酸铜,则必须出去铁离子和亚铁离子。根据表中数据可知要通过沉淀法直接出去亚铁离子,则铜离子也将被同时除去,所以应该把亚铁离子氧化生成铁离子,然后再通过沉淀法出铁离子。因为当氢氧化铁完全沉淀后,铜离子还留在溶液中。所选择的氧化剂不能再引入新的杂质,所以应该选择绿色氧化剂双氧水。
(3)根据图像可知,在80℃pH等于1.5时转化率最高,所以应该控制的条件就是溶液温度控制在80℃,PH控制在1.5,氧化时间为4小时左右。
(4)要得到氢氧化铁沉淀,就有增大溶液的pH,同时还不能引入杂质,所以可选择氧化铜。要分离固液混合物,需要过滤。
(5)参加反应的高锰酸钾是0.0240mol/L×0.016L=0.000384mol,高锰酸钾氧化亚铁离子的方程式为MnO4-+ 5Fe2+ + 8H+="==" Mn2+ + 5Fe3+ + 4H2O,所以消耗的亚铁离子为0.000384mol×5=0.00192mol,所以浓度为
本题难度:一般