1、填空题 元素锶(Sr)位于周期表第5周期第IIA族。碳酸锶(SrCO3)被广泛用于彩色电视机的阴极射线管。以天青石(主要成分为SrSO4,含不溶性杂质)为原料制取高纯碳酸锶的“煅烧浸取法”部分工艺流程示意如下。
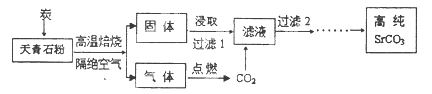
(1)写出与元素锶同族第3周期元素的原子结构示意图:?。
(2)隔绝空气高温焙烧中,若0.5mol SrSO4中只有S被还原,转移了4mol电子。写出该反应的化学方程式:?。
(3)制取高纯碳酸锶过程中,常用乙醇胺(HOCH2CH2NH2)作为CO2吸收剂。乙醇胺水溶液显弱碱性(与NH3溶于水原理相似),原因是?(用离子方程式表示)。
(4)该流程中过滤2之后还有除杂等多步操作,其中最后两步是?。
(5)“低温湿法”是一种制取碳酸锶的方法:将天青石粉末与碳酸钠溶液混合,70oC下加热1~2h后,经一系列操作,得到碳酸锶。主要反应为:
 SrSO4(s)+CO
SrSO4(s)+CO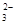 (aq)? SrCO3(s)+SO
(aq)? SrCO3(s)+SO (aq)
(aq)
[已知:70oC时,Ksp(SrSO4)=3.3×10-7,Ksq(SrCO3)=1.1×10-10]
上述反应的平衡常数K=?。
(6)通过“低温湿法”得到的碳酸锶纯度较低,可能的原因是?(写一种)。
参考答案:(14分)(1)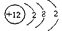 (2分)?
(2分)?
(2)SrSO4+4C SrS+4CO↑(3分)?
SrS+4CO↑(3分)?
(3)HOCH2CH2NH2+H2O HOCH2CH2NH3++OH—(3分)?
HOCH2CH2NH3++OH—(3分)?
(4)洗涤、烘干(2分)?
(5)3×103(2分)?
(6)还含有天青石中原有的不溶性杂质(或SrSO4(s)+CO32—(aq) SrCO3(s)+SO42—(aq)是可逆反应,SrCO3中必定混有SrSO4)(2分)
SrCO3(s)+SO42—(aq)是可逆反应,SrCO3中必定混有SrSO4)(2分)
本题解析:(1)第3周期第IIA族元素为镁,核电荷数为+12,核外电子层结构为282;(2)根据题意可知,硫元素的化合价由+6降为—2,根据电子、原子守恒可知,该反应式为SrSO4+4C SrS+4CO↑;(3)NH3+H2O
SrS+4CO↑;(3)NH3+H2O NH3?H2O
NH3?H2O NH4++OH—,由相似性可知,HOCH2CH2NH2+H2O
NH4++OH—,由相似性可知,HOCH2CH2NH2+H2O HOCH2CH2NH3++OH—;(4)过滤之后,需要洗涤沉淀,除去沉淀表面吸附的可溶物,然后再干燥,除去水分;(5)根据题意,K=
HOCH2CH2NH3++OH—;(4)过滤之后,需要洗涤沉淀,除去沉淀表面吸附的可溶物,然后再干燥,除去水分;(5)根据题意,K=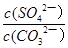 =
=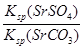 =
= =3×103;(6)SrSO4(s)+CO32—(aq)
=3×103;(6)SrSO4(s)+CO32—(aq) SrCO3(s)+SO42—(aq)是可逆反应,SrCO3中必定混有SrSO4等不溶性杂质。
SrCO3(s)+SO42—(aq)是可逆反应,SrCO3中必定混有SrSO4等不溶性杂质。
本题难度:一般
2、简答题 【化学—选修2:化学与技术】(15分)
 请回答氯碱工业的如下问题:
请回答氯碱工业的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。?
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。?

 ①图中X是__?___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
①图中X是__?___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
 ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
参考答案:(15分)(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89(2分)
(2)③①②(2分)?(3)①Cl2(1分)?a%小于b%?(2分)
②O2+4e-+2H2O=4OH-?(2分)?H2-2e-+2OH-=2H2O (2分)
③燃料电池可以补充电解池消耗的电能(2分));提高产出碱液的浓度(2分;降低能耗(其他合理答案也给分)
本题解析:(1)惰性电极电解饱和食盐水的方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。
2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。
(2)由于除去SO42-时要加入过量的氯化钡溶液,而过量的氯化钡需要碳酸钠除去,所以正确的操作顺序是③①②。
(3)①由于在燃料电池中失去电子的是氢气,所以Y是氢气,则X就是氯气。由于燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%。
②负极是氢气失去电子,正极氧气得到电子,所以电极反应式分别为H2-2e-+2OH-=2H2O 、O2+4e-+2H2O=4OH- 。
③根据装置特点及反应过程可知,这样设计的优点是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗等。
本题难度:一般
3、选择题 下列金属的冶炼适宜用电解法来冶炼的是
A.铁
B.铜
C.钠
D.铅
参考答案:C
本题解析:电解法一般用来冶炼比较活泼的金属,例如钠和铝等,故本题的答案选择C,由Fe、Zn、Cu、Pb等中等活泼金属用热还原法,即以C、CO或H2做还原剂还原冶炼。
点评:本题考查了金属的冶炼,属于对化学基本知识的考查,本题还要掌握:由于Hg、Ag等不活泼金属的氧化物不稳定,受热易分解,一般采用热分解法冶炼;V、Cr、Mn、W等高熔点金属一般用铝热反应产生的高温来冶炼。本题难度适中。
本题难度:一般
4、填空题 (15分)某厂用含有少量杂质FeCl2的CuCl2溶液制备纯净的CuCl2·2H2O晶体, 为降低成本且不造成空气污染,拟定实验步骤如下:
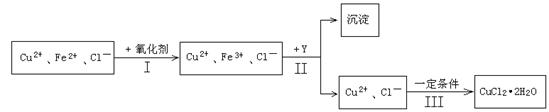
一些金属氢氧化物沉淀的PH
金属离子
| PH
|
开始沉淀
| 沉淀完全
|
Fe2+
| 7.6
| 9.6
|
Fe3+
| 2.7
| 3.7
|
Cu2+
| 4.4
| 4.6
|
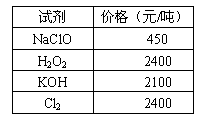
化学试剂价格表
回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母)。
A.H2O2? B.NaClO? C.KOH? D.Cl2
该反应的离子方程式为____________________________________________。
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以选用下列物质中的________________(填字母);
A.NaOH? B.CuO? C.Cu(OH)2? D.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生聚沉。将步骤Ⅱ中沉淀经过适当步骤制成胶体后,再逐滴加入稀硫酸可能看到的现象是_________。
(3)步骤Ⅲ应控制的实验条件是 ________________________??。
参考答案:(15分,每空3分)(1)A? 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
(2)① BCD?②先有红褐色沉淀出现,继续滴加硫酸溶液沉淀溶解得黄色溶液
(3)将溶液在较低温度下加热蒸发析出晶体,同时通以氯化氢气体防止水解。
本题解析:(1)由于在反应中不能引入新的杂质,双氧水的还原产物是是,所以答案选A。
(2)①同样在反应中不能引入新的杂质,所以氢氧化钠不能选用,BCD均是可以的,答案选BCD。
②硫酸是电解质,能使氢氧化铁胶体聚沉,生成氢氧化铁沉淀,又因为硫酸是强酸,所以能继续
溶解氢氧化铁沉淀,生成硫酸铁和水。
(3)氯化铜水解显酸性,水解是吸热的,所以加热促进水解,因此要制备氯化铜晶体,应该在在较低温度下加热蒸发析出晶体,同时通以氯化氢气体防止水解。
本题难度:一般
5、简答题 化学与材料密切关联.
①制造普通玻璃的主要原料是纯碱、石灰石和______.
②钢铁在酸雨中会发生电化学腐蚀,其负极的电极反应是______.
③硫化橡胶具有较高的强度和化学稳定性,它具有______结构.
参考答案:①制造普通玻璃的原料:石灰石 纯碱 石英,故答案为:石英;
②负极铁失去电子转化成二价铁离子电极反应式是Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
③硫化橡胶分子间具有空间网状结构,故答案为:体型(或“网状”或“体型网状”).
本题解析:
本题难度:一般