1、选择题 下列叙述错误的是
A.1mol任何物质都含有约6.02×1023个原子
B.0.012kg12C含有约6.02×1023个碳原子
C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类
D.物质的量是国际单位制中七个基本物理量之一
参考答案:A
本题解析:试题分析:本题考查“物质的量”的基本概念。解题时应审清题意,注意要选的是“正确的”还是“错误的、不正确的”。对于此题是要求我们选出错误的。
选项A、并不是1mol任何物质都含有约6.02×1023个原子。如1molH2应该含有2×6.02×1023个氢原子。故A选项错误。
选项B、以0.012kg12所含的碳原子数作基准,其近似值为6.02×1023个;1mol的任何物质所含有的该物质的微粒数叫做阿伏伽德罗常数,近似值为6.02×1023。故B正确。
选项C、在使用物质的量时,应必须指明粒子的种类,如“1mol氢”这样的描述是模糊不清的,这里的“氢”指代不明,可以理解为氢气(可表示宏观上的也可表示微观上的),也可理解为氢原子。故用摩尔表示物质的量的单位时,必须用化学符号指明粒子的种类。
选项D、物质的量是国际单位制中七个基本物理量之一(7个物理量为长度、质量、时间、电流强度、发光强度、温度、物质的量)。
考点:物质的量;阿伏伽德罗常数
点评:本题是对“物质的量”和“阿伏伽德罗常数”的综合考查。解题时应明确各自的概念,以及这两个概念之间的联系。
1、物质的量(n):表示含有一定数目粒子的集合体。单位:mol
其标准:0.012kg12C所含的碳原子数。
注意:使用物质的量时,需用化学符号指明粒子的种类。
2、阿伏伽德罗常数(NA):1mol的任何物质所含有的该物质的微粒数叫做阿伏伽德罗常数,近似值为6.02×1023。
注意:阿伏伽德罗常数的数值不因温度压强等条件的改变而改变。
3、两者之间的联系:N=n·NA?(N为微粒的粒子数)
本题难度:一般
2、选择题 下列说法错误的是
A.氯气是黄绿色的,氯离子是无色的
B.氢气在氯气中燃烧时发出苍白色火焰
C.氯气有毒,新制的氯水有漂白性,而氯离子既无毒也无漂白性
D.氢气和氯气的混合气体只有在强光照射下才能迅速化合生成氯化氢
参考答案:D
本题解析:试题分析:氢气和氯气在光照的条件下可以迅速化合生成氯化氢,但在点燃的条件下,氢气也可以在氯气中燃烧,发出苍白色火焰,同时也生成氯化氢,选项D不正确,其余选项是正确的,答案选D。
考点:考查氯气及其化合物的性质
点评:该题属于基础性试题,难度不大。主要是检测学生对氯及其化合物性质的熟练掌握程度,属于识记性的。
本题难度:简单
3、选择题 下列说法正确的是
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积约为22.4L
C.在标准状况下,NA个分子所占的体积约为22.4L
D.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L
参考答案:D
本题解析:分析:A根据气体摩尔体积的使用范围判断;
B根据气体摩尔体积的使用条件判断;
C、根据气体摩尔体积的使用范围判断;
D根据气体摩尔体积的定义判断.
解答:A、气体摩尔体积的使用范围是气体,水是液体,故A错误.
B、在标况下,1molH2所占的体积约为22.4L,没有前提条件,故B错误.
C、未注明该物质的状态,不能确定其体积,故C错误.
D、在标准状况下,1mol任何气体所占的体积约为22.4L,任何气体既值纯净物又指混合物,故D正确.
故选:D
点评:本题考查的是气体摩尔体积,注意气体摩尔体积的使用范围、条件,正确理解定义中“任何”的含义.
本题难度:一般
4、选择题 NA代表阿伏加德罗常数.下列说法中正确的是
A.5.6g?乙烯与丁烯的混合物中含σ键的数目为NA
B.25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1?NA
C.用浓盐酸和氯酸钾反应,每生成21.3克氯气,转移电子数为0.5NA
D.标况下,NO和O2各11.2?L混合,所得混合气体的分子总数为0.75?NA
参考答案:C
本题解析:分析:A.乙烯与丁烯中所含有的σ键数目不同;
B.OH-的数目与溶液的体积有关;
C.氯离子失去5mol电子被1mol氯酸根得到,生成3mol氯气,此过程只转移了5NA的电子;
D.标况下,11.2L气体的物质的量为0.5mol,故混合气体的总物质的量为1mol,但是一氧化氮和氧气能发生反应.
解答:A.由于乙烯与丁烯中所含有的σ键数目不同,因此无法判断5.6g?乙烯与丁烯的混合物中的σ键数目,故A错误;
B.不知道溶液的体积,无法求OH-的数目,故B错误;
C.6HCl+KClO3═KCl+3Cl2↑+3H2O,转移只能算单向的,氯离子失去5mol电子被1mol氯酸根得到,生成3mol氯气.此过程只转移了5NA的电子,21.3克氯气的物质的量是0.3mol,故转移电子数为0.5NA,故C正确;
D.NO与O2在标况下反应生成NO2,根据反应的化学方程式可以计算出生成的NO2为0.5mol,剩余的O2为0.25mol,即气体的总的物质的量为0.75mol,但NO2还有一个平衡:2NO2 N2O4,而此平衡的存在就使气体的总的分子数小于0.75mol,故D错误.
N2O4,而此平衡的存在就使气体的总的分子数小于0.75mol,故D错误.
故选C.
点评:本题考查阿伏加德罗常数,题目难度中等,平时注意知识的积累.
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值.下列叙述正确的是
A.25℃,pH=1的稀硫酸中含有的H+数为0.1NA
B.标准状况下,224?mL?水含有的电子数为0.1NA
C.常温常压下,0.56?L甲烷中含有的共价键数为0.1NA
D.0.15?mol?NO2与水完全反应时转移的电子数为0.1NA
参考答案:D
本题解析:分析:A.pH=1的稀硫酸溶液中H+的浓度为0.1mol/L,溶液的体积未知,不能确定H+的物质的量;
B.标准状况下,水为液体,不能使用气体摩尔体积;
C.常温常压下,气体摩尔体积不是22.4L/mol;
D.根据反应式计算生成NO,根据NO的物质的量计算转移电子数目.
解答:A.pH=1的稀硫酸溶液中H+的浓度为0.1mol/L,若溶液的体积为1L,则含有的溶液的H+数为0.1NA,由于溶液体积未知,不能确定H+的物质的量为0.1mol,故A错误;
B.标准状况下,水为液体,不能使用气体摩尔体积,224?mL水的物质的量远大于0.01mol,故B错误;
C.常温常压下,气体摩尔体积不是22.4L/mol,0.56?L甲烷的物质的量为不是0.025mol,含有共价键不是0.1NA,故C错误;
D.根据反应式3NO2+2H2O=2HNO3+NO可知,生成NO为0.15mol×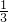 =0.05mol,反应中N元素化合价由+4价降低为NO+2价,故转移电子数目为0.05mol×(4-2))×NAmol-1=0.1NA,故D正确;
=0.05mol,反应中N元素化合价由+4价降低为NO+2价,故转移电子数目为0.05mol×(4-2))×NAmol-1=0.1NA,故D正确;
故选D.
点评:本题考查常用化学计量的有关计算,难度不大,注意气体摩尔体积的使用条件与对象.
本题难度:困难