1、选择题 矿泉水目前已成为人们常用的饮料,市场上有些不法商贩为牟取暴利,用自来水冒充矿泉水出售,为辨别真假,可用下列的一种化学试剂来鉴别,该试剂是
A.酚酞试液
B.氯化钡溶液
C.氢氧化钠溶液
D.硝酸银溶液
参考答案:D
本题解析:试题分析:自来水中一般还采用氯气消毒,因此在自来水中含义以下微粒H+、OH-、Cl-、ClO-、H2O、HClO、Cl2,所以可以通过检验氯离子的存在进行鉴别,即选项D正确。
考点:考查氯水的性质
点评:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。该题也是和生活联系密切的一道化学试题,属于化学在日常生活中的应用,但难度不大。
本题难度:简单
2、选择题 下列各组物质分子数目相同的是
A.同温同压,1mol?O2和2g?H2
B.2g?H2和16g?O2
C.常温常压下,2L?H2和2L?H2O
D.22.4L?Cl2和1mol?H2
参考答案:A
本题解析:分析:A.根据n=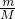 计算2g氢气的物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
计算2g氢气的物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
B.根据n=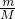 计算氢气、氧气的物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
计算氢气、氧气的物质的量,根据N=nNA可知,物质的量越大,含有分子数目越大;
C.氢气是气态,水是液态,体积之比不低于物质的量之比;
D.未指明氯气所处的状态,气体摩尔体积不一定是22.4L/mol.
解答:A.2g氢气的物质的量为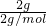 =1mol,氢气与氧气的物质的量相等,根据N=nNA可知,二者含有分子数目相等,故A正确;
=1mol,氢气与氧气的物质的量相等,根据N=nNA可知,二者含有分子数目相等,故A正确;
B.2g氢气的物质的量为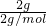 =1mol,16g?O2的物质的量为
=1mol,16g?O2的物质的量为 =0.5mol,二者物质的量不等,根据N=nNA可知,二者含有分子数目不相等,故B错误;
=0.5mol,二者物质的量不等,根据N=nNA可知,二者含有分子数目不相等,故B错误;
C.氢气是气态,水是液态,体积之比不低于物质的量之比,含有的分子数目不相等,故C错误;
D.未指明氯气所处的状态,气体摩尔体积不一定是22.4L/mol,物质的量不一定是1mol,二者物质的量不一定相等,根据N=nNA可知,二者含有分子数目不一定相等,故D错误;
故选A.
点评:本题考查常用化学计量的有关计算,难度不大,注意对公式的理解与灵活运用,注意气体摩尔体积的使用条件与对象.
本题难度:简单
3、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1.0?L?0.1?mol?L-1?Na2CO3溶液中所含的CO离子数为0.1NA
B.质量均为7.8?g?Na2S、Na2O2的固体中含有的阴离子数均为0.1NA
C.标准状况下,22.4?L的CCl4分子中含有共价键数为4NA
D.电解饱和食盐水,当阴极产生2.24?L?H2时,转移的电子数一定为0.2NA
参考答案:B
本题解析:分析:A、碳酸钠溶液中碳酸根离子水解;
B、依据n= 计算物质的量,结合过氧化钠和硫化钠摩尔质量相同,过氧化钠由钠离子和过氧根离子构成分析;
计算物质的量,结合过氧化钠和硫化钠摩尔质量相同,过氧化钠由钠离子和过氧根离子构成分析;
C、CCl4分子在标准状况下不是气体;
D、不是标准状况,气体体积2.24 L H2不一定是0.1mol;
解答:A、碳酸根离子水解,1.0 L 0.1 mol?L-1 Na2CO3溶液中所含的CO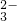 离子数小于0.1NA,故A错误;
离子数小于0.1NA,故A错误;
B、7.8 g Na2S、Na2O2的固体物质的量都是0.1mol,过氧化钠是钠离子和过氧根离子构成,所以含有的阴离子都为0.1mol,阴离子数均为0.1NA,故B正确;
C、CCl4分子在标准状况下不是气体,22.4 L的CCl4分子不是1mol,故C错误;
D、阴极产生2.24 L H2时,温度和压强不一定是标准状况,所以物质的量不一定是0.1mol,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查盐类水解,质量换算物质的量计算微粒数,气体摩尔体积的条件应用,题目难度中等.
本题难度:一般
4、选择题 设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.1?mol甲烷中的氢原子被氯原子完全取代,需要2?nA?Cl2
B.1.5?mol?NO2与足量H2O反应,转移的电子数为2nA
C.常温常压下,46?g的NO2和N2O4混合气体含有的原子数为3nA
D.常温常压下,mg乙烯与mg丙烯中均含有()nA对共用电子对
参考答案:CD
本题解析:分析:A、取代反应的特征是有出有进,有机化合物中的氢原子被其他原子或原子团代替发生的反应;1mol氢原子需要1molCl2取代;
B、根据化学方程式计算电子转移数;
C、二氧化氮和四氧化二氮的组成元素相同,原子个数比相同,所以只需要计算46gNO2中 所含原子数即可;
D、质量换算物质的量,结合分子结构计算共价键物质的量,形成一个共价键需要两个电子;
解答:A、1?mol甲烷中含有4mol氢原子,4molCl2提供4mol氯原子发生取代反应,被氯原子完全取代,需要4?nA?Cl2,故A错误;
B、NO2与足量H2O反应的化学方程式为:3NO2+H2O=2HNO3+NO,每3molNO2反应转移电子物质的量为2mol,所以1.5?mol?NO2与足量H2O反应,转移的电子数为nA,故B错误;
C、NO2和N2O4的最简比相同,只需计算46gNO2中所含原子物质的量即可,46?g的NO2和N2O4混合气体含有的原子数为=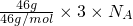 =3nA,故C正确;
=3nA,故C正确;
D、mg乙烯C2H4含有共价键即共用电子对物质的量=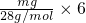 =
=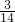 mol,mg丙烯C3H6中含有共价键即共用电子对物质的量=
mol,mg丙烯C3H6中含有共价键即共用电子对物质的量=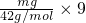 =
=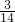 mol,所以,mg乙烯与mg丙烯中均含有(
mol,所以,mg乙烯与mg丙烯中均含有(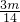 )nA对共用电子对,故D正确;
)nA对共用电子对,故D正确;
故选CD.
点评:本题考查了阿伏伽德罗常数的应用,氧化还原反应的电子转移数的计算,主要考查依据物质的量计算微粒数、共价键、共用电子对数的计算关系.
本题难度:困难
5、选择题 下列各溶液中,钠离子的物质的量浓度最大的是
A.50mL0.4mol/LNaOH溶液
B.40mL0.5mol/LNaCl溶液
C.30mL0.15mol/LNa3PO4溶液
D.20mL0.3mol/LNa2SO4
参考答案:D
本题解析:分析:根据溶质的化学式及物质的量浓度来计算钠离子的物质的量浓度,据此进行判断.注意离子浓度与溶液体积无关系.
解答:A、0.4mol/LNaOH溶液中钠离子浓度为0.4mol/L;
B、0.5mol/LNaCl溶液中钠离子浓度为0.5mol/L;
C、0.15mol/LNa3PO4溶液中钠离子浓度为0.45mol/L;
D、0.3mol/LNa2SO4液中钠离子浓度为0.6mol/L;
故0.3mol/LNa2SO4液中钠离子浓度最大.
故选:D.
点评:本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,所含微粒的物质的量浓度与所取溶液的体积大小无关.
本题难度:困难