1、选择题 在酸性溶液中,下列各组离子能大量共存的是(? )
A.Fe3+、NO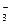 、Cl-、Al3+
、Cl-、Al3+
B.Fe3+、Cl-、I-、K+
C.Fe2+、K+、SO 、NO
、NO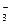
D.Fe2+、SO 、K+、MnO
、K+、MnO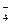
参考答案:A
本题解析:A选项符合题意;B选项中Fe3+和I-能发生氧化还原反应;C、D选项中Fe2+在酸性条件下能被NO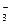 、MnO
、MnO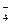 氧化。
氧化。
本题难度:简单
2、实验题 (19分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
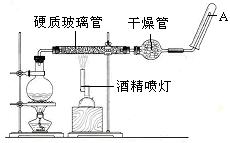
(1)写出该反应的化学方程式?,其中氧化剂是?,还原剂是?。8.4g铁粉参加反应,转移电子?mol。
(2)玻璃管中石棉绒的作用是?,实验开始时应先点燃?,实验结束时应先熄灭?。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是??;烧瓶里应事先放置?,其作用是?。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的
成分是?,若溶液未变红色则说明硬质试管中固体物质的
成分是?。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是?
?(用离子方程式表示)。

(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按上图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关
的反应的化学方程式??,
?。
(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有?性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是?,
并且配制含Fe2+的盐溶液时应加入少量?。
参考答案:(1)3Fe+4H2O(g) 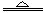 Fe 3O4 +4 H2(不写(g)或“加热”扣1分,写成“高温”不扣分)
Fe 3O4 +4 H2(不写(g)或“加热”扣1分,写成“高温”不扣分)
H2O? Fe? 0.4
(2)铁粉的载体,增大铁粉与水蒸气的接触面积?酒精灯?酒精喷灯
(3)为实验提供水蒸气?碎瓷片?防止暴沸
(4)一定有Fe3O4,可能有Fe(各1分)? Fe3O4和Fe
(5)Fe + 2Fe3+= 3Fe2+?
(6)FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4(1分)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(1分)
(7)还原?Fe2+易被空气中的氧气氧化而变质?铁粉
本题解析:略
本题难度:一般
3、填空题 (10分)向硫酸亚铁溶液中滴加氢氧化钠溶液,实验的现象是:有?色沉淀产生,迅速变为?色,?最后变为?色。有关的化学方程式为:
1)?2)?
参考答案:白?灰绿?红褐
1)FeSO4 + 2NaOH ="=" Fe(OH)2↓ + Na2SO4
2)4Fe(OH)2 + O2 + 2H2O ="=" 4Fe(OH)3
本题解析:考查Fe(OH)2的制取及性质
制取:FeSO4 + 2NaOH ="=" Fe(OH)2↓ + Na2SO4
Fe(OH)2易被氧化,颜色由白色迅速转化为灰绿色,最终为红褐色的Fe(OH)3:4Fe(OH)2 + O2 + 2H2O ="=" 4Fe(OH)3
本题难度:一般
4、实验题 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是Cu2O;
假设3:?。
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。?
(1)若假设1成立,则实验现象是?。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法是否合理,简述你的理由:?
?。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是?,写出发生反应的离子方程式?。
参考答案:(12分)Fe2O3和Cu2O?(1分)(1) 固体完全溶解,溶液呈血红色?(1分)
(2) 不合理?当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀H2SO4后产生的Fe3+可能完全与Cu反应生成Fe2+,滴加KSCN溶液后也可以不变红色。 (2分)
(3)? Fe2O3和Cu2O? Fe2O3+6H+=2Fe3++3H2O?Cu2O+2H+ =Cu+Cu2++H2O?2Fe3++Cu=2Fe2++Cu2+ ?(各2分)
本题解析:根据假设1和假设2可知,假设3应该是红色粉末是Fe2O3和Cu2O。
(1)若假设1成立,则溶液中含有Fe3+,Fe3+遇到KSCN溶液呈红色,即实验现象是固体完全溶解,溶液呈血红色。
(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu可能与Fe3+完全反应生成亚铁离子,即2Fe3++Cu=2Fe2++Cu2+,则加入KSCN溶液也不变色,故此种说法不正确。
(3)固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,反应的有关离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,有利于培养学生的逻辑推理能力和逆向思维能力,有助于提升学生的学科素养,提高学生的学习效率。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论,做题时注意把握题给信息。
本题难度:困难
5、选择题 过量的铁粉与稀硫酸反应后,溶液中存在较多的阳离子是
A.Fe3+
B.Fe2+
C.H+
D.Fe3+和Fe2+
参考答案:B
本题解析:由于铁粉过量,故溶液中的H+几乎被消耗完,而铁粉与水反应会产生Fe2+,故溶液中存在较多的阳离子是Fe2+,由于铁粉过量故不存在Fe3+。故答案选B
点评:本题需要学生对铁性质及Fe2+与 Fe3+互相转化的理解,但由于是过量的铁粉,所以三价不存在。
本题难度:一般