1、填空题 (1)设计一个简单的一次性完成实验的装置,验证醋酸、二氧化碳水溶液(碳酸)和苯酚的酸性,其强弱的顺序是:CH3COOH> H2CO3> C6H5OH
①利用下列仪器可以组装实验装置,则仪器的连接顺序是:?。

②写出实验过程中发生反应的离子方程式。?、?。
(2)若1 mol 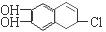 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是?mol和?mol。
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是?mol和?mol。
参考答案:(10分)(1)ADEBCF(2)2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
H2O+CO2+C6H5O-→ C6H5OH+HCO3-?(2)3?和? 3
本题解析:(1)根据较强的酸制备较弱的酸可知,要证明醋酸的酸性强于碳酸的,则应该将醋酸滴入碳酸钠中,然后将生成的CO2通入到苯酚钠中即可,所以正确的连接顺序是ADEBCF。
(2)实验过程中发生反应的离子方程式有2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑、H2O+CO2+C6H5O-→ C6H5OH+HCO3-。
(3)根据有机物的结构简式可知,分子中含有2个酚羟基、1个氯原子、1个碳碳双键,所以能和2mol单质溴发生取代反应,1mol溴发生加成反应,共计是3mol。2mol酚羟基需要2mol氢氧化钠,1mol氯原子水解又需要1mol氢氧化钠,共计是3mol。
点评:该题是基础性试题的考查,试题侧重对学生基础知识的巩固和训练,意在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是记住常见官能团的结构、性质以及官能团之间的相互转化,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和规范的实验设计能力。
本题难度:一般
2、实验题 某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)

参考答案:Ⅰ、Ca2++SO42-==CaSO4↓
Ⅱ、反应存在限度,尚有大量Ca2+
Ⅲ、产生大量白色沉淀
Ⅳ、Ca2++CO32-=CaCO3↓
Ⅴ、加入CO32-产生了大量的白色沉淀,说明Ca2++SO42-==CaSO4反应是可逆反应,存在反应限度,所以
Ca2+不能反应完,才出现这种现象。
本题解析:
本题难度:困难
3、选择题 下列有关实验操作、现象和解释或结论都正确的是
选项
| 实验操作
| 现象
| 解释或结论
|
A
| 过量的Fe粉中加入HNO3,
充分反应后,滴入KSCN溶液
| 溶液呈红色
| 稀HNO3将Fe氧化为
|
B
| AgI沉淀中滴入稀KCl溶液
| 有白色沉淀出现
| AgCl比AgI更难溶
|
C
| Al箔插入稀HNO3中
| 无现象
| Al箔表面被HNO3氧化,形成致密的氧化膜
|
D
| 用玻璃棒蘸取浓氨水点到红色石蕊试纸上
| 试纸变蓝色
| 浓氨水呈碱性
参考答案:D
本题解析:
正确答案:D
本题综合考查化学实验以及元素化合物的相关知识。A选项,铁粉过量应该生成Fe2+,不会有红色出现;AgCl溶解度比AgI大, AgI沉淀中滴入稀KCl溶液不会有白色沉淀出现,故B错;Al箔插入浓HNO3中才会形成致密的氧化膜钝化,稀硝酸中会反应,故C错;D的实验操作、现象和结论都是正确的。
本题难度:一般
4、实验题 某中学高一课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验。
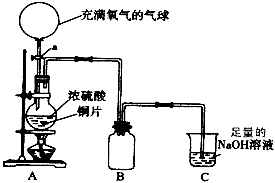
(1)先关闭活塞a,将6.4g铜片和12mL某浓度的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。写出上述过程中烧瓶内发生的化学方程式:
关闭活塞a______________________;打开活塞a______________________;
(2)该小组甲同学对"如何检验SO2中混有少许CO2"这个问题很感兴趣,他将A中铜片换作木炭粉,并在A、B之间连接了如下装置:
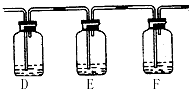
试剂:a.NaOH溶液 b.品红溶液 c.酸性KMnO4溶液 d.Ca(OH)2溶液
请回答:
①该同学的实验装置A中发生的化学方程式:______________________。
②若要达到此目的,可以在:(填所提供试剂编号) D中加入___________;E中加入___________;F中加入___________。
(3)事实证实,第(1)问铜片完全消失后,硫酸仍有剩余,乙同学欲测定余酸的物质的量浓度,假设反应前后溶液体积变化忽略不计,他向反应后溶液中加入含溶质amol的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:___________mol/L(用含a的代数式表达,若不能,该空不填)。
参考答案:(1)①Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;②2Cu+O2+2H2SO4 CuSO4+SO2↑+2H2O;②2Cu+O2+2H2SO4 2CuSO4+2H2O (或分步写成: 2CuSO4+2H2O (或分步写成:
2Cu+O2 2CuO;CuO+H2SO4==CuSO4+H2O) 2CuO;CuO+H2SO4==CuSO4+H2O)
(2)①C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;②c;b;d CO2↑+2SO2↑+2H2O;②c;b;d
(3)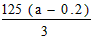
本题解析:
本题难度:困难
5、简答题 如图所示为实验室制取少量硝基苯的装置.根据题意完成下列填空:
(1)写出制取硝基苯的化学方程式______.
(2)长玻璃导管兼做冷凝管,冷凝的是______(填“物质名称”).
(3)用胶头滴管吸取少许上层反应液,滴到水中,当观察到油珠下沉时,表示硝基苯已生成.这样操作的理由是______.
(4)将除去混酸后的粗硝基苯先用冷水洗涤,再用10%碳酸钠溶液洗至不显酸性,最后用水洗至中性.洗涤和分离粗硝基苯的仪器是(填仪器名称)______.检验最后用水洗至中性的操作是______.
(5)经上述洗涤的硝基苯中仍含少量的间二硝基苯等杂质,提纯硝基苯的方法是______.硝基苯有毒,如果少量的液体溅在皮肤上,应用______擦洗.
A.苯B.酒精C.硫酸D.水.

参考答案:(1)实验室用浓硝酸和苯在浓硫酸作用下制备硝基苯,反应的化学方程式为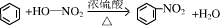 , ,
故答案为: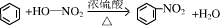 ; ;
(2)苯和硝酸沸点较低,易挥发,可用长玻璃导管冷凝,故答案为:苯和硝酸;
(3)苯比水轻,硝基苯的密度比水大,且不溶于水,当观察到油珠下沉,说明有硝基苯生成,
故答案为:硝基苯和苯都比混合酸轻,但硝基苯比水重、苯比水轻且都不溶于水,所以若油珠下沉,说明有硝基苯生成;
(4)硝基苯和水互不相溶,可用分液的方法分离,可用pH试纸测定溶液的酸碱性,用胶头滴管(或玻棒)取最后一次洗涤液,滴到pH试纸上,测得pH=7,
故答案为:分液漏斗;用胶头滴管(或玻棒)取最后一次洗涤液,滴到pH试纸上,测得pH=7;
(5)硝基苯和间二硝基苯沸点不同,可用蒸馏的方法分离,酒精与硝基苯混溶,如果少量的液体溅在皮肤上,应用酒精洗涤,但不能用苯,苯对人体有害,
故答案为:蒸馏;B.
本题解析:
本题难度:一般
|