1、实验题 (12分)实验室用如图所示的装置制取乙酸乙酯.
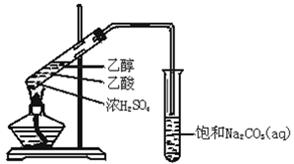
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:?,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管_________________________,目的是_______________。
(3)浓硫酸的作用是①___________;②___________.
(4)饱和Na2CO3溶液的作用是①________________________;②_____________________;
③_____________________________。
(5)生成的乙酸乙酯的化学方程式?。
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).
参考答案:(12分)

本题解析:略
本题难度:简单
2、实验题 (14分)实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
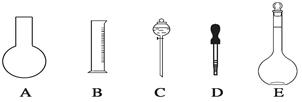
(1)如图所示的仪器中配制溶液肯定不需要的是___________(填序号),配制上述溶液还需用到的玻璃仪器是________________________(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为_______g;根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为______mL。
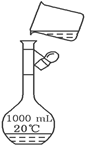
(3)下图是某同学转移溶液的示意图,图中的存在的错误是_______________________。
(4)在实验中其他 操作均正确,若定容时俯视视刻度线,则所得溶液浓度_____0.8 mol/L(填“>、<或=”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度_____0.8 mol/L。
操作均正确,若定容时俯视视刻度线,则所得溶液浓度_____0.8 mol/L(填“>、<或=”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度_____0.8 mol/L。
参考答案:(14分)
(1)A、C;烧杯、玻璃棒
(2)16.0;10.9
(3)
(4)>、=
本题解析:略
本题难度:一般
3、填空题 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是?。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除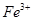 外还可能含有
外还可能含有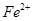 。若要确认其中的
。若要确认其中的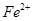 ,应选用?选填序号)。
,应选用?选填序号)。
a.KSCN溶液和氯水? b.铁粉和KSCN溶液?
c.浓氨水? d.酸性 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
 ?,然后加入足量
?,然后加入足量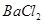 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中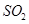 的体积分数为?。
的体积分数为?。
[探究二]
分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
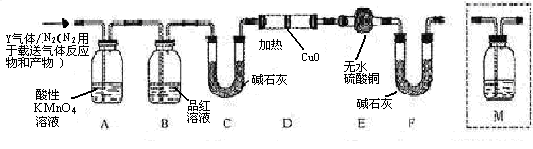
(3)装置B中试剂的作用是?。
(4)认为气体Y中还含有Q的理由是?(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于?(选填序号)。
a. A之前? b.A-B间? c.B-C间? d.C-D间
(6)如果气体Y中含有 ,预计实验现象应是?。
,预计实验现象应是?。
参考答案:(14分)[探究一](1)钝化 (2)①d?②66.7%?
[探究二](3)验证二氧化硫是否除尽(4)2H2SO4(浓)+C 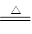 ?2H2O+2SO2↑+CO2↑
?2H2O+2SO2↑+CO2↑
(5)? C?(6)D中黑色变红色,E中白色变成蓝色。
本题解析:(1)由于在常温下,铁在浓硫酸中发生钝化,所以钝化后的铁不能在和硫酸铜溶液反应。
(2)①由于亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化,溶液褪色,所以检验亚铁离子的是试剂是酸性高锰酸钾溶液,答案选d。
②所得固体是硫酸钡,其质量是2.33g,物质的量是0.01mol,则根据反应的化学方程式可知,SO2的我知道了也是0.01mol,标准状况下的体积是224ml,所以气体Y中SO2的体积分数为 。
。
(3)由于铁钉中还含有碳元素,所以生成的气体中还可能含有CO2,检验CO2用石灰水,但SO2也能使石灰水变混浊,所以A装置首先是除去SO2,则B中品红溶液的主要是就是验证二氧化硫是否除尽。
(4)碳和浓硫酸反应的化学方程式是2H2SO4(浓)+C 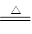 ?2H2O+2SO2↑+CO2↑。
?2H2O+2SO2↑+CO2↑。
(5)在检验氢气之前就要首先检验CO2,所以M装置应该放在B和C之间,答案选C。
(6)由于氢气具有还原性,能和氧化铜反应生成铜和水,所以实验现象就是D中黑色变红色,E中白色变成蓝色。
点评:钢铁是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的和解题方法的指导与训练,有利于培养学生规范、严谨的实验设计和评价能力,提升学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
4、填空题 (8分) 现有分子式均为C3H6O2的四种有机物A、B、C、D,且分子中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
?
| NaOH溶液
| 银氨溶液
| 新制Cu(OH)2
| 金属钠
|
A
| 中和反应
| ——
| 溶?解
| 产生氢气
|
B
| ——
| 有银镜
| 加热后有红色沉淀
| 产生氢气
|
C
| 水解反应
| 有银镜
| 加热后有红色沉淀
| ——
|
D
| 水解反应
| ——
| ——
| ——
|
则A、B、C、D的结构简式分别为:
A?,B?,C?,D?。
参考答案:(8分) A.CH3CH2COOH? B.CH3CHOHCHO? C.HCOOCH2CH3? D.CH3COOCH3
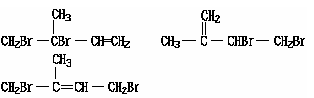
本题解析:略
本题难度:一般
5、实验题 某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
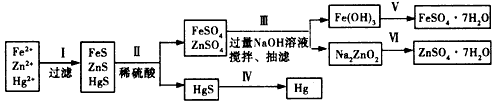
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为____________________
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有
Zn2++4OH-=ZnO22-+2H2O和_______________________
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为_______________________
(4)欲实现步骤V,所需加入的试剂有____、____, 所涉及的主要操作依次为________________
(5)步骤Ⅳ常用的方法是___________,该步骤是否对环境有影响?_______(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应____________________
参考答案:(1)FeS+2H+=Fe2++H2S↑、ZnS+2H+=Zn2++H2S↑
(2)4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
(3)ZnO22-+4H+=Zn2+ +2H2O
(4)稀硫酸;铁粉(过量);过滤、浓缩结晶、过滤
(5)加热;是;在密闭容器中加热HgS
本题解析:
本题难度:一般