1、填空题 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运?用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
____C?+?____K2Cr2O7?+?____→?____CO2↑+?____K2SO4?+?____Cr2(SO4)3?+?____H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+?2H2(g) CH3OH(g)?△H1=-116?kJ/mol
CH3OH(g)?△H1=-116?kJ/mol
①下列措施中有利于增大该反应的反应速率的是?_______;
A.随时将CH3OH与反应混合物分离?
B.降低反应温度?
C.增大体系压强?
D.使用高效催化剂?
②已知:
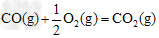 ?△H2=-283?kJ·mol-1?
?△H2=-283?kJ·mol-1?
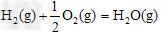 ?△H3=-242?kJ·mol-1
?△H3=-242?kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
请回答:
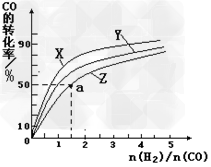
ⅰ)在上述三种温度中,曲线Z对应的温度是___________________;
ⅱ)利用图中a点对应的数据,计算出曲线Z 在对应温度下CO(g)+?2H2(g)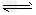 CH3OH(g)?的平衡常数K?=__________。
CH3OH(g)?的平衡常数K?=__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L?,则生成沉淀所需CaCl2溶液的最小浓度为__________。
参考答案:(1)3?2?8H2SO4?3?2?2?8
(2)①CD;②?CH3OH(g)+3/2O2(g) CO2(g)+?2H2O(g)?△H=-651kJ/mol;③ⅰ)270℃;ⅱ)?4?L2/mol2
CO2(g)+?2H2O(g)?△H=-651kJ/mol;③ⅰ)270℃;ⅱ)?4?L2/mol2
(3)1.6×10-5?mol/L
本题解析:
本题难度:一般
2、选择题 可逆反应H2(g)+I2(g)?2HI(g)达到限度时的标志是( )
A.混合气体密度恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
参考答案:A.根据质量守恒定律知,反应前后混合物的质量始终不变,如果容器的体积不变,容器内气体的密度始终不变,故A错误;
B.该反应中碘有颜色,其他物质无颜色,当反应达到平衡状态时,各种物质的物质的量、浓度等不再发生变化,所以混合气体的颜色不再改变,故B正确;
C.平衡时,各物质的浓度与反应的初始浓度、转化率有关,所以H2、I2、HI的浓度相等不等于物质的浓度不变,不是化学平衡状态的标志,故C错误;
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等与反应的初始浓度、转化率有关,不能说明物质的浓度不变,不是化学平衡状态的标志,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题
|
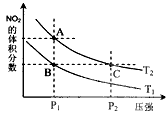
反应N2O4(g)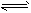 2NO2(g);△H= +57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H= +57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
[? ]
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列叙述及解释正确的是 ( )
A.2NO2(g)(红棕色)  N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B.对于N2(g)+3H2(g) 2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移
2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移
C.FeCl3+3KSCN Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅
D.H2(g)+I2(g)  2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
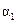 与
与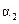 的关系式为
的关系式为  平衡常数表达式为 。
平衡常数表达式为 。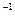 ·min
·min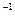 (用含有c2的代数式表示)
(用含有c2的代数式表示) 左”、“向右”或“不动”)
左”、“向右”或“不动”)