|
高考化学知识点总结《化学平衡》考点特训(2019年冲刺版)(二)
2019-07-04 01:07:47
【 大 中 小】
|
1、填空题 某化学反应2A (g)
参考答案:
本题解析:
本题难度:一般
2、选择题 在密闭容器中进行H2(g)+Br2(g)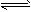 2HBr(g)(正反应放热),反应达到平衡后,欲使颜色加深,应采取的措施是 2HBr(g)(正反应放热),反应达到平衡后,欲使颜色加深,应采取的措施是
[? ]
A.升温
B.降温
C.增压
D.减压
参考答案:AC
本题解析:
本题难度:一般
3、选择题 下列图示与对应的叙述一定正确的是()

A.图1所示,反应X(g)+2Y(g) 3Z(g),b的压强一定比a大 3Z(g),b的压强一定比a大
B.图2表示CO生成CO2的反应过程和能量关系
C.图3表示反应CO+2H2 CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,平衡正向移动,氢气浓度增大 CH3OH,其中温度T1>T2,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,平衡正向移动,氢气浓度增大
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,II表示醋酸,且溶液导电性c>b>a
|
参考答案:C
本题解析:A.由于该反应是反应前后气体体积相等的反应,所以无论是增大压强还是使用催化剂,化学平衡都不移动,因此b的压强不一定比a大,错误;B. 图2表示CO与压强发生生成CO2的反应过程,由于反应物的能量比生成物高,所以该反应是放热反应,正确;C.由图像在温度是T1时首先达到平衡,由于升高温度化学反应速率加快,可知温度T1>T2, 在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,即增大了体系的压强,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,但是平衡移动的趋势是微弱的,总的来说氢气浓度是增大,正确;D.用水稀释pH相同的盐酸和醋酸,由于醋酸是弱酸,在溶液中存在电离平衡,所以产生溶液中离子的浓度变化小,pH变化也小,所以I表示盐酸,II表示醋酸,溶液的pH越大,离子浓度就越小,溶液的导电能力就越弱,所以溶液导电性c<b<a,错误。
考点:考查图像法在化学反应速率、化学平衡、溶液稀释等中的应用的知识。
本题难度:困难
4、填空题 氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分。请回答下列问题:
(1)一定条件下,向一个2L的密闭容器中充入2mol N2和6 molH2,反应达平衡时放出93 kJ热量,生成NH3
的浓度为1mol/L,试写出该反应的热化学方程式:______________________
(2)现有一支10 mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体2 mL。则通入氧气的体积可能为__________________
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)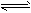 4NO(g)+6H2O(g) 4NO(g)+6H2O(g)
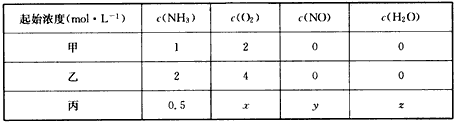
①恒温恒容下,平衡时NH3的转化率甲____(填“>”“=”或“<”)乙。
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=____,y=____,z=____。
(4)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:
2NO2(g)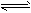 N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和 N2O4(g) △H<0。恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和
a2。已知T1<T2,则a1____a2。
A.大于 B.小于 C.等于 D.以上都有可能
(5)标准状况下,将干燥纯净的氨和二氧化氮气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是____。
A.c(NO3-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(NO3-)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3·H2O)
D.c(NH4+)+c(NH3·H2O)=1.5c(NO3-)
参考答案:(1)N2(g)+3H2(g)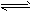 2NH3(g) △H=-93 kJ/mol 2NH3(g) △H=-93 kJ/mol
(2)6 mL和9.5mL
(3)①>;②1.375;0.5;0.75
(4)D
(5)AC
本题解析:
本题难度:困难
5、填空题 在2L密闭容器中充入1mol H2和1mol I2蒸气,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)==2HI(g)? △H<0达到平衡时候n(H2)为0.8mol
(1) 保持容器容积不变,向其中加入1molH2,反应速率?(填加快、减慢、不变、不确定),理由是?。
(2) 保持容器气体压强不变,向其中加入1molHe,反应速率?(填加快、减慢、不变、不确定),理由是?。平衡?(正向或逆向或不)移动
(3)计算该温度下的平衡常数
参考答案:(1)加快?增加反应物氢气的浓度,反应速率加快,
(2)减慢?体积增大,浓度降低,所以反应速率减慢?不
(3)K=0.25
本题解析:(1)增大反应物氢气的浓度,反应速率增大。
(2)保持容器气体压强不变,向其中加入1molHe,则容器容积必然是增大的,所以物质的浓度是降低的,因此反应速率降低;由于正反应是体积不变的可逆反应,所以改变压强平衡不移动。
(3)达到平衡时候n(H2)为0.8mol,则消耗氢气是0.2mol,因此消耗单质碘也是0.2mol,生成HI是0.4mol,所以平衡时氢气、单质碘和HI的浓度分别是(mol/L)0.4、0.4、0.2,因此平衡常数K=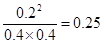 。 。
点评:压强对反应速率或平衡状态的影响只能适用于有气体参加或生成的,且实质是通过改变浓度引起的。而化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。
本题难度:一般
|