1、选择题 下列两种物质混合后不能发生离子反应的是( )
A.硝酸溶液和碳酸钠溶液混合
B.氯化钠溶液和硝酸银溶液混合
C.硫酸钾溶液和氯化钡溶液混合
D.硝酸钾溶液和氯化钡溶液混合
2、选择题 可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中)。
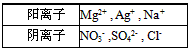
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除H+、OH-外还含有五种离子。则A的化学式不可能是
[? ]
A. AgNO3
B. Na2SO4
C. MgCl2
D. MgSO4
3、填空题 目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是?。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:

①写出反应①的离子方程式?。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)?Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是?。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是?。
(4)FeO42—在水溶液中的存在形态图如图所示。
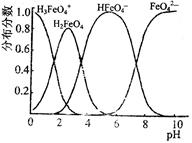
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是?。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,?转化为?(填化学式)。
4、选择题 根据下表提供的数据可知能大量共存的微粒组是
A.H2CO3、HCO3-、CH3COO-、ClO-
B.HClO、 HCO3-、CH3COO-、ClO-
C.HClO 、HCO3-、ClO-、CO32-
D.HCO3-、CH3COO-、ClO-、CO32-
5、实验题 (12分)某无色溶液中含有K+、SO32-、SO42-、Cl、OH-,检验溶液中除OH-外其他阴离子的步骤如下图所示。

回答下列问题:
(1)填写试剂的化学式①?②?⑤?。
(2)试剂④可能是??(填选项字母)。
A.石蕊试液
B.硫酸铜溶液
C.溴水
D.品红溶液