1、选择题 关于下列四个图像的说法中正确的是

[? ]
A.图④表示可逆反应“CO(g)+H2O(g)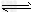 CO2(g)+H2(g)” 中的△H大于0
CO2(g)+H2(g)” 中的△H大于0
B.图②是以石墨为电极电解氯化钠稀溶液的电解池,在阴、阳极收集到的气体体积之比一定为1:1
C.图③表示25℃时,用0.1mol/L盐酸滴定20mL 0.1mol/LNaOH溶液,溶液的pH随加入酸体积的变化
D.图④中曲线表示反应:2SO2(g)+O2(g)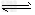 2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化
2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化
参考答案:D
本题解析:
本题难度:一般
2、填空题 2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念。
(1)广州亚运会火炬“潮流”采用了丙烷(C3H8)作为燃料,燃烧后的产物为水和二氧化碳。在298 K时,
1 mol丙烷完全燃烧生成CO2和液态水放出2221.5 kJ的热量,则该反应的热化学方程式为____________。
又知:在298 K时
C3H8(g)=C3H6(g)+H2(g) △H =124.2 kJ/mol,
H2(g)+1/2O2(g)=H2O(l) △H=-285.8 kJ/mol,
则1 mol C3H6完全燃烧生成CO2和液态水时放出的热量是_____________kJ。
(2)广州是一座美丽的海滨城市,海水资源非常丰富。
①海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为4Al+3O2+6H2O=4Al(OH)3,下列说法正确的是__________(填写序号字母);
a.电池工作时,电流由铝电极沿导线流向铂电极
b.铂电极采用网状比块状更利于O2放电
c.海水中的OH-向铝电极方向移动
②用惰性电极电解200 mL l.5 mol/L食盐水;电解2 min时,两极共收集到448 mL气体(标准状况下),写出该电解反应的离子方程式:___________________。假设电解前后溶液的体积不变,则电解后该溶液的pH为___________。
参考答案:(1)C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2221.5 kJ/mol;2059. 9
(2)①bc;②2Cl-+2H2O 2OH-+H2↑+Cl2↑;13
2OH-+H2↑+Cl2↑;13
本题解析:
本题难度:一般
3、实验题 食盐是日常生活的必需品,也是重要的化工原料。
Ⅰ?粗食盐常含有少量K+、Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下
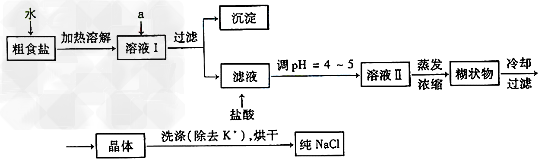
提供的试剂:饱和Na2CO3溶液?饱和K2CO3溶液?NaOH溶液?BaCl2溶液? ?Ba(NO3)2溶液?75%乙醇?四氯化碳?冷水
① 欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
____________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为__________________。
③在整个实验过程中,下列实验装置不可能用到的是_____________(填序号)。

④【有关资料】
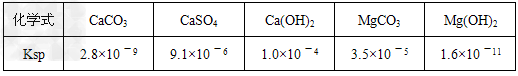
溶液Ⅰ中加入试剂a,只要控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时滤液中Mg2+物质的量浓度将被控制在__________以下。
Ⅱ?我国化学工程专家侯德榜创立的侯氏制碱法,食盐是其中的主要原料。实验室根据侯氏制碱法并参考下表数据,制备纯碱的主要步骤是:将配置好的NaCl饱和溶液倒入烧杯中加热,控制一定温度范围,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30min,静置、过滤得晶体NaHCO3。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2h,制得Na2CO3固体。
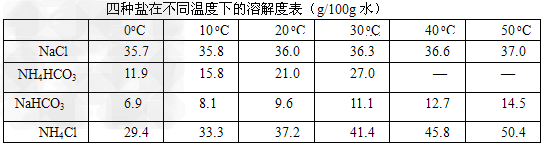
※ 温度高于35℃,NH4HCO3会有分解请回答:该反应的方程式:_________________
操作过程中反应温度控制在30℃?<t<_______为控制此温度范围,采取的加热方式为________________。
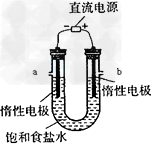
Ⅲ?电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2?________?(填“>”、“=”或?“<”)2L,原因是___________________?。装置改进后,可用于制备NaOH溶液,若测定溶液中 NaOH的浓度,常用的方法为________________。装置b口出来气体的检验方法:_______________________。
参考答案:Ⅰ(1)①BaCl2 、Na2CO3、NaOH ;②75%乙醇;③A、C;④ 1.6 ×10-7 mol/L
ⅡNaCl + NH4HCO3 = NaHCO3↓+ NH4Cl ;35℃;水浴加热
(3 )<;产物Cl2和NaOH会反应,Cl2 + 2NaOH = NaCl+ NaClO + H2O ;酸碱中和滴定;将湿润的淀粉-KI 试纸放在b 口,若试纸变蓝,说明有Cl2产生
本题解析:
本题难度:一般
4、填空题 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
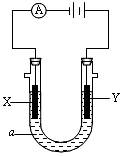
(1)电解过程中反应的总化学方程式为________________;X极附近观察到的现象是____________。
(2)Y电极上的电极反应式为__________________;检验该电极反应产物的方法是_______________。
参考答案:(1)2NaCl+2H2O 2NaOH+Cl2↑+H2↑;酚酞变红,有气泡产生
2NaOH+Cl2↑+H2↑;酚酞变红,有气泡产生
(2)2Cl--2e-═Cl2↑;用湿润的淀粉碘化钾试纸放在Y极附近观察现象
本题解析:
本题难度:一般
5、填空题 (1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置。
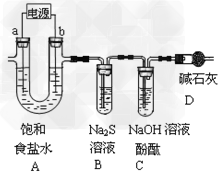
①电解一段时间后,B中出现浑浊现象,请用离子方程式表示原因______________。此时电极a附近的现象为_____________,因此工业上电解所用的食盐水需精制。?
②随反应的进行,C中溶液红色褪去,主要原因有两种可能。请按要求填写表格。
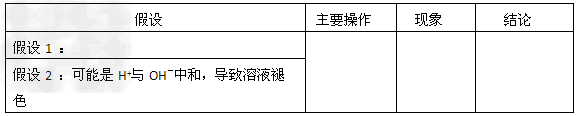
(2)电解饱和食盐水所得气体X,可应用于提取溴单质。现有流程图如下
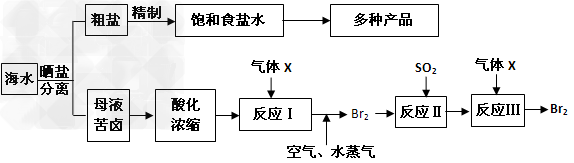
请回答:
①?气体X的化学式为_______,反应II的化学方程式为____________________。?
②?在母液苦卤中含有较多的NaCl、KCl、MgCl2、MgSO4等物质。用沉淀法测定苦卤中镁元素的含量(g/L),实验过程中应测定的数据有________________。
③?电解200kg?质量分数为25%的饱和食盐水,当浓度下降到20%时,收集到氯气的物质的量为________________?(溶于溶液中的氯气忽略不计,计算结果保留一位小数)?。?
参考答案:(1)①?Cl2?+?S2-=?2Cl-+?S↓;有无色气泡产生,溶液出现浑浊?
②
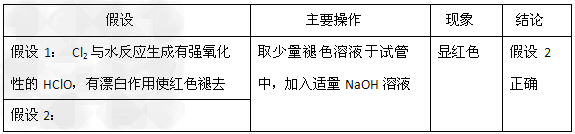 (2)①?Cl2;SO2+Br2+2H2O=2HBr+H2SO4;②?苦卤样品的体积、Mg(OH)2沉淀的质量;
(2)①?Cl2;SO2+Br2+2H2O=2HBr+H2SO4;②?苦卤样品的体积、Mg(OH)2沉淀的质量;
③?97.7mol
本题解析:
本题难度:一般