1、选择题 用NA表示阿伏加德罗常数的值。下列叙述正确的是?(?)
A.标准状况下,2.24 L CCl4含有0.1 NA个CCl4分子
B.1.5molCu和足量稀硝酸反应产生NA个NO分子
C.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
D.18gD2O含有的质子数为10NA
参考答案:B
本题解析:A 错误,.标准状况下,CCl4是液体。
B 正确,1.5molCu失去3mol电子,稀硝酸生成NA个NO分子得到3mol电子。
C 错误,标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA
D 错误,18gD2O不是1mol,含有的质子数小于10NA
本题难度:一般
2、填空题 实验室配制480 mL 0.1mol·L-1?NaOH溶液,回答下列问题
(1)应用托盘天平称取氢氧化钠固体?g。
(2)配制NaOH溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒?、?。
使用容量瓶前必须进行的操作是?。
(3)配制时,该实验两次用到玻璃棒,其作用分别是?、?。
(4)定容时若加水超过刻度线,应如何处理??。
(5)试分析下列操作对所配溶液的浓度有何影响。
A. 偏高? B. 偏低? C.不变(用符号回答)
① 定容时俯视刻度线?;
② 放在滤纸上称量NaOH固体?。
③容量瓶没有干燥,有少量蒸馏水:?。
④定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度:?。
(6)请你帮助把试剂瓶(盛放上述配制好的溶液)上标签的内容填上去 (标签如图)。

参考答案:
(1)2.0g?(2)500mL容量瓶?胶头滴管。?检查是否漏水
(3)搅拌,?引流?(4)重新配制
(5)① A ② B ③ C ④ B
(6)NaOH溶液,0.1mol/L
本题解析:本题考查的是一定物质的量浓度溶液的配制,因为题中所要求的是480 mL 0.1mol·L-1?NaOH溶液,但是实验室中没有480 mL的容量瓶,只能选用500 mL的容量瓶来代替,那么在计算所称取的氢氧化钠的质量时,就得按480 mL 0.1mol·L-1?NaOH溶液来计算所用的氢氧化钠。因此为m(NaOH)=0.5L×0.1mol·L-1?×40g/mol=2.0g,在此必须写2.0g,因为我们是要用托盘天平来称量的,而托盘天平可以精确到小数点后一位数字。容量瓶在使用之前必须要进行是否漏水的检验。配制时,两次用到玻璃棒,一次是用来搅拌溶解固体的,再一次是用来引流的;如果定容时超过了刻度线,那么只能倒重新配制,因为你不可能从容量瓶中吸出多余的水,你加的时候是水,再吸出来的时候成份已经变了。定容时俯视刻度线,会导致加水的量少,结果偏高;放在滤纸上称量NaOH固体,会导致吸收二氧化碳变质,使得氢氧化钠少,浓度偏低;容量瓶没有干燥,有少量蒸馏水,不影响结果;定容后,加盖倒转摇匀后,发现液面低于刻度线,是因为有一部分液体残留在了瓶颈口,又滴加蒸馏水至刻度,使得加水多了,导致结果偏低。配完以后,将配好的溶液转移到细口试剂瓶中之后,要贴标签,标签是先写溶液的名称,再写浓度。
本题难度:一般
3、计算题 (5分)右图是“康师傅”牌饮用矿泉水标签的部分内容。请认真阅读标签内容,计算:

①镁离子的物质的量浓度的最大值。
②一瓶合格的这种矿泉水中SO42-的物质的量不能超过多少摩尔?
参考答案:① 2 ×10?4mol/L? 2分?②? 7.1×10-5mol? 3分
本题解析:①镁离子合理最多是4.8mg/L,即1L溶液中含有4.8mg镁离子,其物质的量是
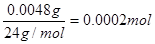 ,所以镁离子浓度是2 ×10?4mol/L。
,所以镁离子浓度是2 ×10?4mol/L。
②SO42-的合理最高是不能超过19.5mg/L,所以一瓶矿泉水中SO42-的质量最多是19.5mg/L×0.35L=6.825mg,物质的量是 7.1×10-5mol。
7.1×10-5mol。
本题难度:一般
4、选择题 V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为( )
A.56m/V mol·L-1
B.3m/56V mol·L-1
C.m/56V mol·L-1
D.3m/112V mol·L-1