1、选择题 质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为
A.大于2c mol/L
B.等于2c mol/L
C.小于2c mol/L
D.在c mol/L—2c mol/L之间
参考答案:A
本题解析:溶质的质量分数与溶液中溶质的物质的量浓度关系为: ;且KOH溶液中,溶质的质量分数越大,溶液的密度越大;令质量分数为a%的溶液的密度为ρ1,2a%的溶液密度为ρ2;则可得
;且KOH溶液中,溶质的质量分数越大,溶液的密度越大;令质量分数为a%的溶液的密度为ρ1,2a%的溶液密度为ρ2;则可得
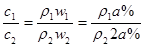 ,由于ρ1<ρ2,所以可求得质量分数变为2a%,则物质的量浓度变为大于2c mol/L?;
,由于ρ1<ρ2,所以可求得质量分数变为2a%,则物质的量浓度变为大于2c mol/L?;
本题难度:一般
2、填空题 (8分)某液体化合物X2Y4,常用做火箭燃料。16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)===X2(g)+2Y2O(l)。冷却后标准状况下测得生成物的体积为11.2 L,其密度为1.25g/L,则:
(1)反应前O2的体积V(O2)为________。
(2)X2的摩尔质量为________;Y元素的名称是________。
(3)若反应生成0.1mol X2,则转移电子的物质的量为________mol。
参考答案:(1)11.2L;(2)28g/mol;氢元素;(3)0.4。
本题解析:根据题意知,X元素形成的气体单质标准状况下的密度为1.25g/L,X2的摩尔质量为1.25g/L×22.4L/mol=28g/mol则反应后的气体为N2,11.2L氮气的物质的量为0.5mol。(1)由反应方程式知,N2和氧气的物质的量之比为1:1,所以生成N2的体积等于氧气的体积为11.2L;(2)X元素形成的气体单质标准状况下的密度为1.25g/L,X2的摩尔质量为1.25g/L×22.4L/mol=28g/mol;根据氮气和N2Y4的关系式知,反应N2Y4的物质的量为0.5mol,则M(N2Y4)=32g/mol,N元素的相对原子质量是14,所以Y的相对原子质量是1,为氢元素;(3)N元素的化合价由-2价变为0价,所以若反应生成0.1mol X2,则转移电子的物质的量=0.1mol×2×(2-0)=0.4mol。
考点:考查根据化学方程式计算。
本题难度:一般
3、选择题 下列说法正确的是
[? ]
A.1molO2和1molN2?所占体积都约为22.4L
B.H2的气体摩尔体积约为22.4L
C.在标况下,1molH2和1molH2O所占的体积都约为22.4L
D.在标况下,22.4L由N2、N2O组成的混合气体中所含有的N的物质的量约为2mol
参考答案:D
本题解析:
本题难度:简单
4、实验题 (6分)某学生用已知质量y g的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如图所示):
(1)下面他的操作应该是______________________,使_________________。
(2)若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mLNaOH溶液过程示意图中有错误的是(填操作序号)?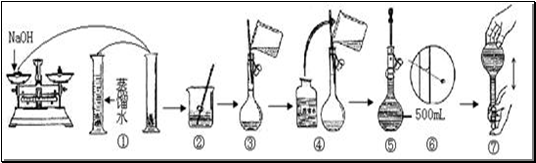
参考答案:继续往表面皿中加入NaOH固体,使指针刚好停在中间刻度
①③⑥(每空2分)
本题解析:(1)指针偏向右边,说明右侧重,氢氧化钠的质量不足。因此正确的操作是继续往表面皿中加入NaOH固体,使指针刚好停在中间刻度。
(2)量筒只能量取液体,不能用来稀释,①不正确。转移时玻璃棒的下端应靠在容量瓶中刻度线的下面,③不正确。定容时读数应该是平时读数,⑥不正确。所以答案选①、③、⑥。
本题难度:一般
5、计算题 今年暑假里学校化学实验室装修,药品被转移到了安全的场所保管,但是因为工作人员的疏忽,有几瓶氢氧化钠没有及时转移,开学后才发现,现在需要测定氢氧化钠是否有变质,变成了什么。所以某兴趣小组接下了任务,他们是这么做的:常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,反应过程中没有观察到气泡,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
?
| ?氢氧化钠质量(g)
| ?氯化钠质量(g)
|
①
| ? 2.40
| ? 3.51
|
②
| ? 2.32
| ? 2.34
|
③
| ? 3.48
| ? 3.51
|
?
上述实验①②③数据可靠。通过计算,分析和比较上表3组数据,给出结论。
参考答案:第一组为氢氧化钠?第二组、第三组都为一水合氢氧化钠
本题解析:加入盐酸,反应过程中没有观察到气泡,说明不含Na2CO3或NaHCO3,
NaCl的物质的量为:3.51g÷58.5g/mol=0.06mol ,根据钠元素守恒,NaOH的物质的量为:0.06mol,样品的摩尔质量为:2.40g÷0.06mol=40g/mol,所以样品为NaOH。
NaCl的物质的量为:2.34g÷58.5g/mol=0.04mol,根据钠元素守恒,NaOH的物质的量为:0.04mol,样品的摩尔质量为:2.32g÷0.04mol=58g/mol,所以样品为NaOH?H2O。
NaCl的物质的量为:3.51g÷58.5g/mol=0.06mol,根据钠元素守恒,NaOH的物质的量为:0.06mol,样品的摩尔质量为:3.48g÷0.06mol58g/mol,所以样品为NaOH?H2O。
本题难度:一般