1、选择题 下列离子中外层d轨道达半充满状态的是(? )
A.24Cr3+
B.26Fe3+
C.27Co3+
D.29Cu+
参考答案:B
本题解析:24Cr3+的外围电子排布式为:3d34s0,26Fe3+的为:3d54s0;27Co3+:3d64s0,故B正确。
本题难度:简单
2、选择题 主族元素X和Y ,Xm-和Yn+核外电子排布相同,下列说法正确的为(? )
A.X的原子半径大于Y
B.X和Y的核电荷数之差为m-n
C.电负性X>Y
D.第一电离能X<Y
参考答案:C
本题解析:Xm-和Yn+核外电子排布相同,说明X是非金属,Y是金属,位于X的下一周期。所以原子半径是Y大于X,A不正确。B不正确,例如钠离子和氟离子,C正确。第一电离能是Y小于X,D不正确,所以正确的答案是C。
本题难度:一般
3、选择题 2006年10月9日,朝鲜强迈“核”门槛进行了核实验,引起了国际社会的广泛关注。目前,核反应产生的核能主要来源于 U的裂变,则下列说法中正确的是
U的裂变,则下列说法中正确的是
A. U原子核中有92个质子、143个核子
U原子核中有92个质子、143个核子
B. U的一种可能的裂变是变成两个中等质量的原子核,核反应方程为
U的一种可能的裂变是变成两个中等质量的原子核,核反应方程为
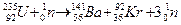 ,说明U是由Ba和Kr组成的
,说明U是由Ba和Kr组成的
C. U是天然放射性元素,常温下它的半衰期约为45亿年,升高温度半衰期缩短
U是天然放射性元素,常温下它的半衰期约为45亿年,升高温度半衰期缩短
D.若一个铀核在裂变前后的质量亏损为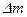 ,则其释放的核能为
,则其释放的核能为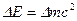
参考答案:D
本题解析: U的质量数是235,质子数是92,种子数是143,A错;U裂变生成Ba和Kr,非Ba和Kr组成的,B错;半衰期与温度没有关系,C错。
U的质量数是235,质子数是92,种子数是143,A错;U裂变生成Ba和Kr,非Ba和Kr组成的,B错;半衰期与温度没有关系,C错。
本题难度:一般
4、选择题 下列粒子中与Na+电子数和质子数都相等的是?(?)
A.OH-
B.NH4+
C.H2O
D.O2-
参考答案:B
本题解析:Na+电子数和质子数分别是10和11,A中电子数和质子数分别是10和9,B中电
子数和质子数分别是10和11,C中电子数和质子数分别是10和10,D中电子数和质子数分
别是10和8,答案选B。
点评:该题是高考中的常见题型和重要的考点,属于基础性试题的考查。试题基础性强,侧
重对学生基础性知识的巩固与训练。该题的关键是明确质子数与电子数的计算方法,然后结
合题意灵活运用即可,难度不大。
本题难度:简单
5、填空题 (15分)A、B、C、D、E、F五种短周期元素的原子序数依次增大。周期表中A元素的原子半径最小,B形成化合物种类最多,C是空气中含量最多的元素,D是地壳中含量最多的元素,短周期主族元素中E的原子半径最大且其单质能与冷水剧烈反应,F既能与盐酸反应也能与烧碱溶液反应制得A单质。
(1)B在周期表中的位置是____________________,C的原子结构示意图为________
(2)A、B形成的最简单化合物名称是___________,分子构型是__________________
(3)BD2的结构式为:__________。已知:298K,BD生成1molBD2(g)时放出热量283.0kJ·mol-1,B单质生成1molBD2(g)时放出热量393.5kJ·mol-1,则B单质反应生成BD的热化学方程式为?。
(4)室温时,仅由B、D、E三种元素形成的某种常见的离子化合物水溶液的pH_____7(填“>”、“=”或“<”),理由是(用离子方程式表示)_________________________________
(5)硒(se)是人体必需的微量元素,与D同一主族,Se原子比D原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_________。
(6)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式是
__________________________________________________________
(7)A单质和D单质可组成最简单的燃料电池,若用稀硫酸作电解质,该电池的正极反应式是:______________________________________________
参考答案:(共16分)(1)第二周期ⅣA族(1分) 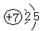 ?(1分)
?(1分)
(2)甲烷 (1分)?正四面体(1分)
(3)O=C=O(1分)? C(s) +1/2O2(g)="CO(g)" ΔH= -110.5kJ·mol-1(2分)
(4) >(1分)? CO32-- + H2O HCO3-- +OH-- (2分)?(5)34(1分)? H2SeO4(1分)
HCO3-- +OH-- (2分)?(5)34(1分)? H2SeO4(1分)
(6)Al2O3 +2OH- +3H2O=2[Al(OH)4]—(2分)
(7)O2 +4e- +4H+=2H2O(2分)
本题解析:A、B、C、D、E、F五种短周期元素对应元素为:H、C、N、O、Na、AL;
(1)?碳元素位于:第二周期ⅣA族;N的原子结构示意图为: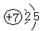
(2)?碳、氢形成的简单化合名称:甲烷;甲烷为空间正面体形;
(3)?CO2的结构式为:O=C=O;由CO的燃烧热、C的燃烧热的热化学方程式可得C生成CO的热化学反应方程式:C(s) +1/2O2(g)="CO(g)" ΔH= -110.5kJ·mol-1;
(4)?由B、D、E三种元素形成的某种常见的离子化合物为碳酸钠,溶液显碱性,即PH>7;理由是CO32-- + H2O HCO3-- +OH-- ;
HCO3-- +OH-- ;
(5)?Se的原子序数为34;最高价氧化物对应的水化物化学式为H2SeO4;
(6)?F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式是:Al2O3 +2OH- +3H2O=2[Al(OH)4]—;或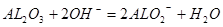 ;
;
(7)?氢氧燃料电池,在酸性溶液中,正极电极反应式为:O2 +4e- +4H+=2H2O
本题难度:一般