|
高考化学知识点总结《磷及其化合物》高频考点巩固(2019年模拟版)(六)
2019-07-04 01:29:44
【 大 中 小】
|
1、选择题 电闪雷鸣的雨天,空气中的N2会发生一系列反应,生成氮的化合物。雷雨时,一般不可能生成的氮的化合物的是(?)
①NH3?②NO?③NO2?④N2O3?⑤N2O5?⑥HNO3
A.①④⑤
B.①③⑤
C.②④⑥
D.②③⑤⑥
参考答案:A
本题解析:打雷放电时,N2+O2 2NO,2NO+O2====2NO2,3NO2+H2O====2HNO3+NO,HNO3随雨水进入土壤。 2NO,2NO+O2====2NO2,3NO2+H2O====2HNO3+NO,HNO3随雨水进入土壤。
本题难度:简单
2、实验题 (18分) (1)某实验小组的甲同学用图l所示装置制取少量乙酸乙酯(加热设备及夹持固定装置均略去)。
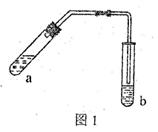  
①试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是?。
②试管a中加入碎瓷片的作用是?,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是?(填序号)。
A.立即补加
B.不需补加
C.冷却后补加
D.重新配料
| ③实验中加热试管a的目的是:(i)?;(ii)?。
④试管b中盛有饱和Na2CO3溶液,其作用是?。
⑤反应结束后,振荡试管b,静置。观察到的现象是?。
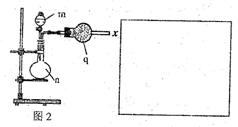
(2)该小组的乙同学利用图2所示装置制备并收集干燥的NO2气体。
①图2中仪器n的名称是?。
②请在方框内画出用集气瓶收集NO2的装置图。
③写出仪器n中发生反应的离子方程式:?。
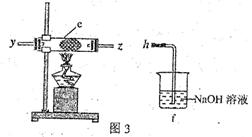
(3)该小组的丙同学利用图2所示装置制取NH3和O2的混合气体,并且利用图3所示装置验证NH3的某些性质。m中加入浓氨水,q中加入碱石灰,e内放置催化剂(铂石棉),按气流方向连接各仪器x→y→z→h。
①图2仪器n内需加入固体试剂的名称为?。
②实验中观察到e内有红棕色气体出现,证明氨气具有?性,e中发生反应的化学方程式为?。
参考答案:(1)①先加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸?②防止暴沸;C
③加快反应速率;及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动
④吸收随乙酸乙酯蒸出的少量乙酸和乙醇 ⑤b中的液体分层,上层是透明的油状液体
(2)①圆底烧瓶 ②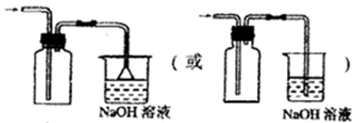
③Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
(3)①过氧化钠 ②还原 ③4NH3+5O2 4NO+6H2O、2NO+O2=2NO2 4NO+6H2O、2NO+O2=2NO2
本题解析:(1)①浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸。
②液体加热要加碎瓷片,防止暴沸,如果加热一段时间后发现忘记加碎瓷片,应冷却至室温,补加碎瓷片,故答案为:防止暴沸;C。
③实验中加热试管,反应的温度高,反应速度快,该反应为可逆反应,温度高,乙酸乙酯的沸点低,易挥发,所以化学平衡向正反应方向移动,利于生成乙酸乙酯,故答案为:加快反应速率;及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动。
④制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯。
⑤乙酸乙酯,其密度比水小,所以在碳酸钠溶液层上方有无色油状液体出现。
(2)①根据仪器的结构特点可知,图2中仪器n的名称是圆底烧瓶。
②二氧化氮气体易溶于水,所以不能用排水法收集;二氧化氮的密度大于空气的密度且和氧气不反应,所以可以采用向上排空气法收集,另外NO2是大气污染物,需要有尾气吸收装置,则装置图为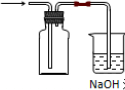 。 。
③铜与浓硝酸反应的离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑。
(3)①过氧化钠与H2O反应生成氢氧化钠和氧气,同时放出大量热,温度升高使浓氨水中氨的溶解度减小而逸出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;②氨气中氮元素的化合价是-3价,二氧化氮中氮元素的化合价是+4价,反应前后氮元素的化合价升高,所以氨气作还原剂,体现其还原性;氨气和氧气在一定条件下反应生成一氧化氮和水,一氧化氮和氧气能反应生成二氧化氮,反应方程式为:4NH3+5O2 4NO+6H2O、2NO+O2=2NO2。2制备的实验方案设计与评价 4NO+6H2O、2NO+O2=2NO2。2制备的实验方案设计与评价
本题难度:困难
3、选择题 在1mol/L的氨水1L中,下列有关说法正确的是?(?)
A.NH3·H2O为1mol ,溶质质量为35g
B.NH4+为1mol ,溶质质量为18g
C.溶解状态的NH3分子为1mol,溶质质量为17g
D.氨水中NH3、NH3·H2O、NH4+三种微粒总的物质的量为1mol 。
参考答案:C
本题解析:略
本题难度:一般
4、计算题 将25 mL NO2与O2的混合气体通入水后,只剩余5 mL气体,求原混合气体中NO2和O2各占多少毫升?
参考答案:原混合气体中NO2和O2可能分别为16 mL和9 mL或23 mL和2 mL。
本题解析:根据反应式4NO2+2H2O+O2====4HNO3,吸收后剩余气体有两种可能:①为O2,②为NO,而剩余5 mL NO是由过量NO2与H2O反应而来,所以实际过量为 15 mL NO2。
①设剩余5 mL为O2,NO2体积为x,O2总体积为y,NO2反应完。
4NO2+O2+2H2O====4HNO3
x? 0.25x
依题意为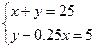 ?解得 ?解得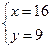
②设剩余5 mL为NO,O2用完。
4NO2+O2+2H2O====4HNO3
4y? y
3NO2+H2O====2HNO3+NO
x-4y?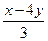
依题意有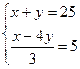 ?解得: ?解得: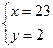
本题难度:简单
5、实验题 某研究性学习小组对氨气的制法进行了如下设计:
(1)下面是该小组同学提出的实验室制备氨气的几种方案:
A.硝酸铵固体与氢氧化钠固体共热
B.加热分解NH4Cl晶体
C.将浓氨水逐滴加到新制的生石灰中
你认为其中较为简便易行的方案有_______________(填写字母);其反应的化学方程式为__________________________________。
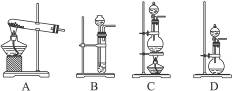
请从上图的仪器中选择制取氨气的发生装置(要求仪器少、合理)__________(写编号)。
(2)该小组需收集干燥后的氨气:
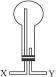
①如选用如右图所示的装置,则气体应由导管口_______(填“X”或“Y”)导入(集气瓶不能颠倒)。
②若用排液集气法收集氨气,可选用的试剂是_______(填字母)
A.H2O? B.浓H2SO4?C.CCl4? D.NaCl饱和溶液
(3)用图示装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是___________
________________________。
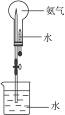
(4)若原烧瓶中氨气是充满的,进行喷泉实验后,烧瓶内溶液中溶质的物质的量浓度为_________(假定在标准状况下)。
参考答案:(1)C? CaO+NH3·H2O====Ca(OH)2+NH3↑? D
(2)①X?②C?(3)打开止水夹,挤出胶头滴管中的水
(4)0.045 mol·L-1
本题解析:(1)硝酸铵受热分解,温度不同产物不同,而且容易发生爆炸;氯化铵分解虽然也产生氨气,但氨气和氯化氢气体在试管口又能化合成氯化铵,因此,只能将氨水逐滴加到新制的生石灰中。(2)氨气密度比空气小,可用向下排空气法收集;氨气极易溶于水,不能用排水集气法,浓硫酸能与氨气反应,也不能用排硫酸收集。(4)设烧瓶的体积为V L,则c(NH3·H2O)=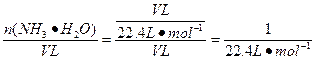 ="0.045" mol·L-1。 ="0.045" mol·L-1。
本题难度:简单
|