1、实验题 N2O5是一种新型硝化剂,其性质和制备受到人们的关注。






(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是?。
(2)一定温度下,在恒容密闭容器中N2 O5可发生下列反应:
 2N2O5(g)? 4NO2(g)+O2(g);ΔH>0
2N2O5(g)? 4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将?。(填“增大”或“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
t/s
| 0
| 500
| 1000
|
c(N2O5)/mol·L-1
| 5.00
| 3.52
| 2.48
|
则500s内N2O5的分解速率为?。
③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2?T1。
?
(3)如上图所示装置可用于制备N2O5,则N2O5在电解池的
?区生成,其电极反应式为?.
参考答案:
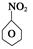 (1)
(1)
(2)①不变
②0.002 96 mol·L-1·s-1
③<或小于
(3)阳极 N2O4+2HNO3-2e-=2N2O5+2H+
本题解析:
(2)①因为恒容下充入N2,N2为非反应性气体,所以平衡不移动,因而N2O5的转化率不变。
②v(N2O5)=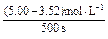
="0.002" 96 mol·L-1·s-1。
③T1温度下c (NO2)求算:
 2N2O5(g)?4NO2(g)+O2(g);ΔH>0
2N2O5(g)?4NO2(g)+O2(g);ΔH>0
2? 4
1 000 s时,5.00-2.48? c(NO2)
c(NO2)=2×(5.00-2.48) mol·L-1="5.04" mol·L-1>4.98 mol·L-1,由于反应是吸热反应,故温度越高NO2的浓度越大,所以得到T2<T1。
(3)由图中给定两极物质可以判断N2O5必是由N2O4氧化生成,所以N2O5在阳极产生。据电极反应离子放电顺序可知:阴极发生2H++2e-→H2↑的反应,则阳极为N2O4+2HNO3-2e-→2N2O5+2H+。
本题难度:一般
2、填空题 (15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程:
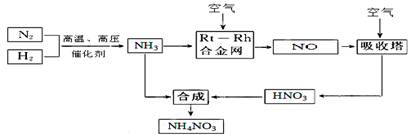
回答下列问题:
(1)N2的电子式?,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 ?。
(2)氨催化氧化的化学方程式是?,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响?。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法?。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答)?。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将?(填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为?(25℃时,Kb(NH3·H2O)="2.0" × 10-5?mol·L-1)。
参考答案:(1)? ;N2(g)+3H2 (g)
;N2(g)+3H2 (g)  2NH3 (g) ?△H="-34a" kJ/mol?
2NH3 (g) ?△H="-34a" kJ/mol?
(2)4NH3 + 5O2? ?4 NO+6H2O ;合成氨正反应放热,低温有利于提高转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。
?4 NO+6H2O ;合成氨正反应放热,低温有利于提高转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。
(3)用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。(其他合理答案也可)
(4)NH4++ H2O ? ?NH3 ·H2O +H+;(5)逆向? x/200y mol·L-1
?NH3 ·H2O +H+;(5)逆向? x/200y mol·L-1
本题解析:(1)在氮气分子中两个N原子共用三对电子,所以N2的电子式是 ;根据题意可得合成氨气的反应的热化学方程式为N2(g)+3H2 (g)
;根据题意可得合成氨气的反应的热化学方程式为N2(g)+3H2 (g)  2NH3 (g)?△H="-34a" kJ/mol ;(2)氨在催化剂表面被氧化为NO。该催化氧化的化学方程式是4NH3 + 5O2?
2NH3 (g)?△H="-34a" kJ/mol ;(2)氨在催化剂表面被氧化为NO。该催化氧化的化学方程式是4NH3 + 5O2? ?4 NO+6H2O ; 由于合成氨正反应是放热反应,所以从平衡角度看低温有利于提高反应物的转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。(3)若输送NH3的管道某处发生泄漏,检测的简单方法是用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。或用蘸有浓盐酸的玻璃棒靠近,有白烟产生。(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,这是因为硝酸铵是强酸弱碱盐。该盐会发生水解反应:NH4++ H2O ?
?4 NO+6H2O ; 由于合成氨正反应是放热反应,所以从平衡角度看低温有利于提高反应物的转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。(3)若输送NH3的管道某处发生泄漏,检测的简单方法是用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。或用蘸有浓盐酸的玻璃棒靠近,有白烟产生。(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,这是因为硝酸铵是强酸弱碱盐。该盐会发生水解反应:NH4++ H2O ? ?NH3 ·H2O +H+,消耗了水电离产生的OH-,破坏了水的大量平衡,水会继续电离,当最终达到电离平衡时c(H+)>c(OH-),所以溶液显酸性。(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水电离产生铵根离子和OH-,会对水的电离起抑制作用。所以滴加氨水过程中水的电离平衡将逆向移动。在该溶液中,存在电荷守恒c(NH4+)+(H+)=c(NO3-)+c(OH-).由于溶液为中性,所以c(NH4+)=c(NO3-)。由于Kb(NH3·H2O)="2.0" × 10-5?mol/L,即
?NH3 ·H2O +H+,消耗了水电离产生的OH-,破坏了水的大量平衡,水会继续电离,当最终达到电离平衡时c(H+)>c(OH-),所以溶液显酸性。(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水电离产生铵根离子和OH-,会对水的电离起抑制作用。所以滴加氨水过程中水的电离平衡将逆向移动。在该溶液中,存在电荷守恒c(NH4+)+(H+)=c(NO3-)+c(OH-).由于溶液为中性,所以c(NH4+)=c(NO3-)。由于Kb(NH3·H2O)="2.0" × 10-5?mol/L,即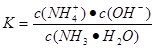 ,所以c(NH3·H2O)= c(NH4+)·c(OH-) /Kb={(x÷y)×10-7}÷2.0 × 10-5?mol/L=" x/200y" mol/L。
,所以c(NH3·H2O)= c(NH4+)·c(OH-) /Kb={(x÷y)×10-7}÷2.0 × 10-5?mol/L=" x/200y" mol/L。
本题难度:一般
3、填空题 海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
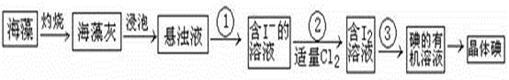
(1)实验操作①的名称是?;实验操作③的名称是??、?,所用主要仪器名称为 ??。
(2)提取碘的过程中,可供选择的有机试剂是 ??(填序号)。
A.酒精(沸点78℃)? B.四氯化碳(沸点77℃) C.甘油(沸点290℃)?
D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,应加入适量的(填序号)??溶液,反应的离子方程式为 ??。
A.KIO3? B.KClO? C.KI? D.Br2?
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如下图所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)
①??,②??,③???,
④??……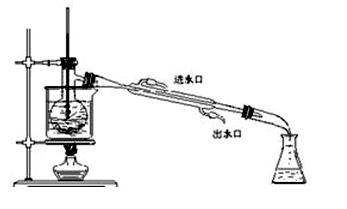
参考答案:(1)过滤?;?萃取分液;分液漏斗(3分每格1分)
(2)BD?(1分)
(3)C?(1分);ICl+I-=Cl-+I2?(2分)
(4)① 缺石棉网?② 温度计插到液体中 ③ 冷凝管进出水方向颠倒
(3分每格1分)
本题解析:略
本题难度:一般
4、选择题 等质量的CuO和MgO粉末分别溶于相同体积 的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol·?L-1(忽略溶液体积变化)。则a与b的关系为
的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol·?L-1(忽略溶液体积变化)。则a与b的关系为
A.a="b"
B.a="2b"
C.2a="b"
D.无法确定
参考答案:C
本题解析:略
本题难度:简单
5、选择题 下列气体颜色为红棕色的是
A.SO2
B.Cl2
C.NO2
D.N2
参考答案:C
本题解析:NO2为红棕色气体;
其余三项依次为无色、黄绿色、无色;
本题难度:简单