1、判断题 将硼酸、发烟硫酸、萤石粉共热得到无色气体A,A为平面构型分子,密度约为空气的2.3倍,A用乙醚吸收后得到液态物质B。液态乙酸中存在微弱的自偶电离,离子电导率为139μS/cm,将B加入乙酸中形成均一透明的无色溶液,发现乙酸的离子电导率显著增强,达到1300-5800μS/cm,B与乙酸的混合溶液是具有良好应用前景的非水型电解质,与传统的水溶液电解质体系相比有独特的优势,扩大了电化学反应研究的物质范围和电位研究区间。试回答下列问题:
⑴ 写出A、B的结构简式? A _____________,B______________
⑵ 写出生成A的化学反应方程式____________________________________
⑶ 用方程式表示乙酸的自偶电离过程,并分析乙酸中加入B后,电导率显著提高的原因
⑷ 红外光谱显示,纯乙酸中存在两种羧羟基吸收峰,分析这两种峰产生的原因
⑸ 为什么说非水型电解质可以扩大电化学反应研究的物质范围和电位区间?
参考答案:⑴ A:BF3,? B:(CH3CH2)2O·BF3?(2分,各1分)
⑵ 3H2SO4 + 2H3BO3 + 3CaF2 ="==" 2BF3 + 3CaSO4 + 6H2O? 2分
⑶ 2CH3COOH 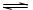 ?CH3COOH2+ + CH3COO-,加入(CH3CH2)2O·BF3后,(CH3CH2)2O·BF3
?CH3COOH2+ + CH3COO-,加入(CH3CH2)2O·BF3后,(CH3CH2)2O·BF3
是强路易斯酸,形成了CH3COOBF3-离子,促进了乙酸的自偶电离
2CH3COOH + BF3 ="=" CH3COOBF3- + CH3COOH2+?(2分)
⑷ 乙酸中存在单分子和缔合分子两种状态?(1分)
⑸ 水溶液中难溶或不溶的物质在非水电解质中可以研究,故扩大了研究的物质范围;在水溶液中,电解电位受到析氢电位和析氧电位的区间限制,而非水电解质中扩大了研究的电位区间限制。(意思对即可)(2分)
本题解析:⑴ A的摩尔质量约为29×2.3=67(g/mol),且为平面分子,结合反应物中存的原子种类,可以推测A为BF3,经验证正确。B为BF3与O(CH2CH3)2的简单加合产物,即F3B←O(CH2CH3)2。
⑵ A的生成过程可以看成是两个反应的结果,即CaF2与浓H2SO4反应生成HF,然后生的HF迅速与H3BO3发生化学反应生成BF3和水。当然也可以把两个方程式写成一个反应方程式:3H2SO4 + 2H3BO3 + 3CaF2 ="==" 2BF3 + 3CaSO4 + 6H2O。
⑶ 自偶电离过程,可以与水的自偶电离进行类比。因此乙酸的自偶电离过程可表示为:2CH3COOH 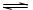 ?CH3COOH2+ + CH3COO-,即乙酸分子之间H+的传递过程。当乙酸中加入B后,溶液导电能力明显增加,说明溶液中可以“自由”移动离子浓度增加,也就是说B的加入促进了乙酸的电离,这是因为BF3是强的路易斯酸,它能与CH3COO-形成稳定的配合物,从而促进了乙酸的电离。
?CH3COOH2+ + CH3COO-,即乙酸分子之间H+的传递过程。当乙酸中加入B后,溶液导电能力明显增加,说明溶液中可以“自由”移动离子浓度增加,也就是说B的加入促进了乙酸的电离,这是因为BF3是强的路易斯酸,它能与CH3COO-形成稳定的配合物,从而促进了乙酸的电离。
⑷ 在单分子的乙酸,由于只存在一种化学环境的羧羟基,因此只能在红外光谱中观察到一种吸收峰。但是在实际情况中存在两种红外吸收峰,也就意味着存在两种不同化学环境的羧羟基,结合乙酸的性质,说明纯乙酸中,有一部分乙酸以单分子形式存在,也存在一部分因氢键形成了双聚的乙酸分子。
⑸ 水溶液中难溶或不溶的物质在非水电解质中可以研究,故扩大了研究的物质范围;在水溶液中,电解电位受到析氢电位和析氧电位的区间限制,而非水电解质中扩大了研究的电位区间限制。
本题难度:一般
2、选择题 下面有关离子化合物的说法正确是
A.离子化合物中一定含有金属元素,含金属元素的化合物一定是离子化合物。
B.离子键只存在于离子化合物中,离子化合物中一定含有离子键
C.离子化合物中不可能含有共价键
D.离子化合物受热融化破坏化学键,吸收能量,属于化学变化
参考答案:B
本题解析:离子化合物中不一定含有金属元素,例如氯化铵等。含金属元素的化合物也不一定是离子化合物,例如氯化铝等,A不正确;离子键只存在于离子化合物中,离子化合物中一定含有离子键,B正确;离子化合物中可能含有共价键,例如氢氧化钠等,C不正确;离子化合物受热融化破坏化学键,吸收能量,但并没有生成新物质,不属于化学变化,D不正确,答案选B。
点评:该题是中等难度的试题,主要是考查学生对化学键以及化学键与化合物关系、离子化合物熔融时变化的判断等基础知识的熟悉了解程度,以及灵活运用基础知识解决实际问题的能力的培养。注意学会举例排除筛选得出正确结论的解题方法。
本题难度:简单
3、选择题 下列说法正确的是
A.共价化合物一定属于原子晶体
B.含离子键的一定属于离子化合物,含共价键的一定属于共价化合物
C.氢键理论是由科学家鲍林提出来的
D.在分子晶体中必有共价键和分子间作用力
参考答案:C
本题解析:A:HCl为共价化合物,属于分子晶体;B:前半句正确,但后半句错误,NaOH含有共价键,但为离子晶体;C:化学史知识,记下即可;D:He形成的晶体中无共价键;
本题难度:一般
4、选择题 对于反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,若有0.1molKMnO4参加反应,下列说法中正确的是
A.还原剂是KMnO4
B.生成Cl25.6L
C.参加反应的HCl为16mol
D.其转移电子为0.5mol
参考答案:D
本题解析:分析:得电子的反应物是氧化剂,失电子的反应物是还原剂,根据元素化合价的变化判断氧化剂和还原剂以及电子转移的数目.
解答:A.该反应中高锰酸钾中的锰元素化合价降低,所以高锰酸钾是氧化剂,故A错误;
B.根据反应方程式知,若有0.1molKMnO4?参加反应,应有0.25mol氯气生成,温度和压强未知,所以无法计算其体积,故B错误;
C.由方程式可知,若有0.1molKMnO4?参加反应,应有0.8molHCl参加反应,故C错误;
D.转移电子的物质的量为0.1mol×(7-2)=0.5mol,故D正确;
故选D.
点评:本题考查氧化还原反应,题目难度中等,易错选项是B,有关气体体积的计算一定要注意温度和压强,没有标明温度和压强,气体摩尔体积不能 用22.4L/mol,为易错点.
本题难度:一般
5、选择题 下列有关晶体的说法中正确的是( ? )
A.分子晶体中均存在共价键
B.原子晶体中共价键越弱,熔点越低
C.晶体在受热融化过程中一定存在化学键的断裂
D.原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力
参考答案:B
本题解析:稀有气体分子中不存在化学键,A不正确。分子晶体受热熔化时,破坏的是分子间作用力,C不正确。在分子晶体还中可能存在共价键,D不正确。所以正确的答案是B。
本题难度:一般