1、选择题 下列说法正确的是
A.1摩尔的气体只有在标准状况下才能是22.4升
B.同温同压下,相同体积气体所含原子个数相同
C.标准状况下1摩尔的水的体积约为22.4升
D.同温同压下,相同体积的H2、O2,其质量比为1︰16
参考答案:D
本题解析:A错,气体的体积受温度和压强的影响;B错,同温同压下,相同体积气体所含分子个数相同;C错,水在标准状况下为冰水混合物;D正确;
本题难度:一般
2、选择题 向某碳酸钠溶液中逐滴加1 mol·L─1的盐酸,测得溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2,则下列说法中正确的是 (? )
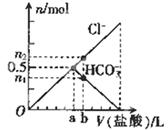
A.Oa段反应的离子方程式与ab段反应的离子方程式相同
B.该碳酸钠溶液中含有1mol Na2CO3
C.b点的数值为0.6
D.b点时生成CO2的物质的量为0.3 mol
参考答案:C
本题解析:注意审题,向某碳酸钠溶液中逐滴加的盐酸,考虑到应该有以下两个依次进行的反应:Na2CO3+HCl=NaCl+Na HCO3①;Na HCO3+HCl=NaCl+H2O+CO2↑②。再分析溶液中Cl─、HCO3─的物质的量随加入盐酸体积的关系图,可见Cl─的量一直在增加,而HCO3─开始和Cl─的量增加相同,到加入aml盐酸时HCO3─的量随着盐酸的加入在减少,说明这时开始发生反应②,所以A错误。加入aml盐酸时,此时溶液中Na2CO3恰好反应完,从图中可知物质的量Cl─= HCO3─=0.5mol,由反应①可知Na2CO3的物质的量应为0.5mol,所以B错误。再接着分析加入bml盐酸时,物质的量Cl─: HCO3─=3:2,由反应②可知道增加了0.1molCl─就会减少0.1mol的HCO3─,所以此时n(Cl─)=0.6mol,n(HCO3─)=0.4mol,所以此时加入盐酸的体积为0.6L,C正确。由反应②可计算反应0.1mol的HCO3─应该生成0.1mol的CO2气体,所以D错误。
其中n2:n1=3:2,
点评:熟记碳酸盐和盐酸的分步反应,再依据题意具体分析,此类属于中等难度题型。
本题难度:一般
3、选择题 物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当他们的体积比为3:2:1时,三种溶液中Cl-离子的物质的量之比是
[? ]
A.?1:1:1?
B.?1:2:3?
C.?3:2:1?
D.?3:4:3
参考答案:D
本题解析:
本题难度:简单
4、选择题 N2、O2、CO2的混合气体通过足量的Na2O2,充分反应后,体积变成原体积的7/9(同温同压),则原混合气体中N2、O2、CO2物质的量之比不可能为 ( )
A.4∶3∶2
B.1∶4∶4
C.3∶2∶4
D.5∶5∶8