1、选择题 0.5L硫酸溶液中溶有9.8gH2SO4,则此溶液的物质的量浓度为( )
A.2mol?L-1
B.1mol?L-1
C.0.2mol?L-1
D.0.1mol?L-1
2、选择题 用胆矾配制0.1mol/L的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16g溶解在1L水当中
B.称取胆矾25g,溶解在1L水当中
C.将25g胆矾溶于水,然后将此溶液稀释至1L
D.将16g胆矾溶于水,然后将此溶液稀释至1L
3、选择题 配制250 mL 0.10 mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是
[? ]
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.在容量瓶中进行定容时仰视刻度线
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
4、简答题 实验室配制500mL?0.1mol/L的NaOH溶液,有如下操作步骤:
①计算所需NaOH固体的质量并用托盘天平称取;
②将称量好的NaOH固体放入烧杯中,加入适量的蒸馏水溶解;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;
④继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面与刻度线相切;
⑤塞紧容量瓶的塞子,充分摇匀.
回答下列问题:
(1)本实验中除用到容量瓶和烧杯外,还需要用到的玻璃仪器有:______.
(2)实验中用托盘天平实际称取NaOH固体的质量是______.
(3)上述实验操作步骤缺少一步,请补充所缺步骤的位置及内容:______.
(4)在实验中,未进行操作④,所配溶液的浓度会______(填“偏高”、“偏低”或“无影响”,下同);定容时俯视液面,所配溶液的浓度会______.称量时已观察到NaOH吸水,所配溶液的浓度会______.
5、实验题 (1)下列实验操作或对实验事实的描述不正确的是___________?(填序号)。?
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠?
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大?
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出?
D.用托盘天平称量11.74?g氯化钠晶体?
E.用结晶法分离硝酸钾和氯化钠的混合物?
(2)实验室需要0.1?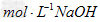 溶液450?mL和0.5?
溶液450?mL和0.5?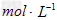 硫酸溶液500?mL。根据这两种溶液的配制情况回答下列问题:?
硫酸溶液500?mL。根据这两种溶液的配制情况回答下列问题:?
①如图所示的仪器中配制溶液肯定不需要的是__________?(填序号);配制上述溶液还需用到的玻璃仪器是__________?(填仪器名称)。?
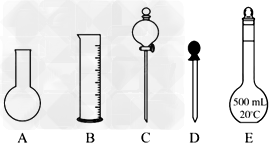
②下列操作中,容量瓶所不具备的功能有___________(填序号)。?
A.配制一定体积准确浓度的标准溶液?
B.贮存溶液?
C.测量容量瓶规格以下的任意体积的液体?
D.准确稀释某一浓度的溶液?
E.用来加热溶解固体溶质?
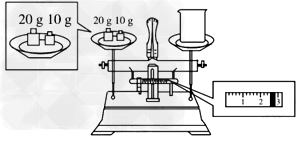
③请计算需用托盘天平称取固体NaOH的质量为__________?g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,烧杯的实际质量为__________g。?
④根据计算得知,所需质量分数为98%、密度为1.84?g/cm3的浓硫酸的体积为__________ mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________________________。?