1、填空题 已知 2Na2O2+2CO2=2Na2CO3+O2,因此Na2O2可在呼吸面具和潜水艇里作供氧剂。
(1)请在答卷上用双线桥法标出上述方程式的电子转移方向和数目。
(2) 是还原剂, 是还原产物。
(3)若转移3mol电子,则所产生的氧气在标准状况下的体积为 。
参考答案: (1)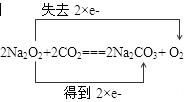 [得失未写或电子数写错均不得分]
[得失未写或电子数写错均不得分]
(2)Na2O2 Na2CO3 (3)33.6L [每空2分]
本题解析:(1)过氧化钠与二氧化碳的反应中,过氧化钠既是氧化剂又是还原剂,
(2)过氧化钠既是氧化剂又是还原剂,还原产物是氧化剂发生还原反应后的产物,为Na2CO3
(3)每生成1mol的氧气,则转移2mol电子,当转移3mol电子时会有1.5mol的氧气生成,标准状况下的体积为33.6L
考点:考查氧化还原反应中氧化剂、还原剂、还原产物的判断及双线桥法表示电子转移等
本题难度:一般
2、填空题 溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在 ??条件下进行,目的是为了避免?。
(2)Br2可用热空气吹出,其原因是?。
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 ??。步骤②的产品有时运输到目的地后再酸化,主要是因为 ?.
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中?。?
a.通入HBr? b.加入Na2CO3溶液? c.加入NaBr溶液? d.加入Na2SO3溶液
参考答案:
(1)酸性,Cl2歧化。
(2) Br2易挥发。
(3)3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O.溴酸能将Cl-氧化成Cl2,原因是Br2有强氧化性。
(4)ac。
本题解析:Cl2与水发生歧化反应:Cl2+H2O=HCl+HClO,在酸性条件下可抑制该反应。步骤③所发生反应是归中反应,盐酸有还原性,NaBrO3有氧化性,二者可发生氧化还原反应;因为Br2有强氧化性,为了防止在运输过程中Br2与其它物质反应,因此步骤②的产品有时运输到目的地后再酸化。利用Br-与Cl2反应,可除去Cl2。
【考点定位】本题考查工业制Br2,考查分析问题解决问题的能力。
本题难度:一般
3、选择题 食盐、蔗糖、醋酸、“84消毒液”、明矾等是灾后居民日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的结构示意图为:
B.蔗糖和醋酸都是弱电解质
C.“84消毒液”中有效成分NaClO的电子式为: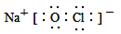
D.明矾溶液水解可制得Al(OH)3胶体,用于杀菌消毒
参考答案:C
本题解析:A、Cl?最外层电子数为8,错误;B、蔗糖为非电解质,错误;C、“84消毒液”中有效成分为NaClO,Cl与O之间形成一个共价键,Na+与ClO?之间形成离子键,正确;D、明矾溶液水解可制得Al(OH)3胶体,可用于吸附悬浮性杂质,不能用于杀菌消毒,错误。
本题难度:一般
4、简答题 计算题
(Ⅰ)将一定质量的Fe溶于100mL4mol/L的过量稀盐酸中,完全反应后收集到H23.36L(标准状况下),若反应前后溶液的体积不变.求:
(1)被氧化的铁的质量.
(2)生成的FeCl2的物质的量浓度.
(3)反应后的溶液中H+的物质的量浓度.
(Ⅱ)在标准状况下,100mL某气体的质量是0.179克.计算这种气体的相对分子质量?
参考答案:(Ⅰ)标况下3.36LH2的物质的量为3.36L22.4L/mol=0.15mol,
则由方程式Fe+2HCl=FeCl2+H2↑可知:
n(Fe)=n(H2)=0.15mol
n(HCl)=2n(H2)=0.15mol×2=0.3mol
n(FeCl2)=n(H2)=0.15mol
(1)被氧化的铁的质量为0.15mol×56g/mol=8.4g,
答:被氧化的铁的质量为8.4g.
(2)溶液体积为100mL,生成的FeCl2的物质的量浓度为0.15mol0.1L=1.5mol/L,
答:生成的FeCl2的物质的量浓度为1.5mol/L.
(3)溶液中H+的物质的量浓度的变化量为0.3mol0.1L=3mol/L,故反应后溶液中H+的物质的量浓度为4mol/L-3mol/L=1mol/L,
答:反应后的溶液中H+的物质的量浓度为1mol/L.
(Ⅱ)标况下,100mL该气体的物质的量=0.1L22.4L/mol=0.122.4mol,
故该气体的摩尔质量=0.179g0.122.4mol=40.1g/mol,故该气体的相对分子质量为40.1,
答:气体的相对分子质量为40.1.
本题解析:
本题难度:简单
5、选择题 下列有关化学用语表示正确的是
A.中子数为20的氯原子: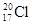
B.CO2的比例模型:
C.铝原子的结构示意图: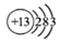
D.聚丙烯的结构简式: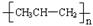
参考答案:C
本题解析:A、中子数为20的氯原子,质量数是37,所以应表示成: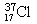 1737Cl
1737Cl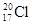 ,错误;B、二氧化碳分子中,碳原子的半径大于氧原子半径,错误;C、铝是13号元素,核外电子排布是2、8、3,所以原子的结构示意图:
,错误;B、二氧化碳分子中,碳原子的半径大于氧原子半径,错误;C、铝是13号元素,核外电子排布是2、8、3,所以原子的结构示意图: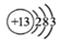 ?,正确;D、聚丙烯的结构简式为
?,正确;D、聚丙烯的结构简式为  ,错误,答案选C。
,错误,答案选C。
本题难度:简单