1、选择题 两种金属的混合物共15g,跟足量的盐酸反应时,恰好得到11.2L氢气(标况)。下列各组金属不可能构成上述条件的混合物的是
A.镁和银
B.铜和锌
C.铝和铁
D.镁和铁
参考答案:B
本题解析:略
本题难度:简单
2、填空题 (6分).实验室中要除去细碎铜屑中的少量细碎铁屑,某同学设计了两个方案:
(1)Cu、Fe 过滤
过滤 洗涤
洗涤
(2)Cu、Fe 过滤
过滤 洗涤
洗涤
两个方案较好的是_______________(填序号),理由是______________________________。你是否有简便的方法,若有,请写出做法:__________________________________________。
参考答案:(2);既除去了铁,而同时又增加了铜;?用磁铁吸取铁屑
本题解析:由于在方案(2)中既除去了铁,而同时又增加了铜,而方案(1)不能使铜的质量增加,所以最后的是方案(2);由于磁铁能吸引铁,所以也可以用磁铁吸取铁屑。
本题难度:一般
3、实验题 (16分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:

 请回答下列问题:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加?,该过程的现象为:?。
(2)步骤②加入过量H2O2的目的:?。
(3)步骤③中反应的离子方程式:?。
(4)步骤④中一系列处理的操作步骤:过滤、?、灼烧、?、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量? g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行 铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
铁元素含量的测定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需?。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是__? __。
a.稀硝酸? b.稀硫酸? c.稀盐酸? d.浓硝酸
③滴定到终点时的颜色为?色。
参考答案:(16分)
(1)氯水(或双氧水等合理氧化剂)(1分); 溶液由浅绿色变成血红色(1 分)
(2)将Fe2+全部氧化成Fe3+(2分)
(3)Fe3+ +3OH-=FeOH)3↓(或Fe3++3NH3·H2O="FeOH)3↓+" 3NH4+ )(3分)
+3OH-=FeOH)3↓(或Fe3++3NH3·H2O="FeOH)3↓+" 3NH4+ )(3分)
(4)洗 涤(1分);冷却(1分)
涤(1分);冷却(1分)
(5)0.07a(3分)
(6)250mL容量瓶(1分);b(1分);紫(或紫红)(2分)
本题解析:略
本题难度:一般
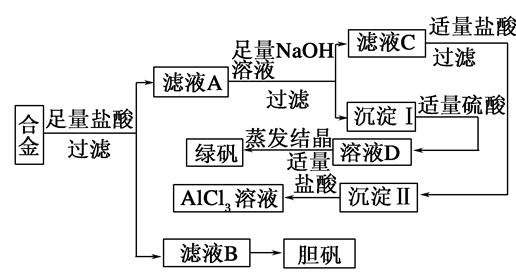
4、填空题 某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理”?或“不合理”),理由是__________。
参考答案:(1)烧杯、漏斗、玻璃棒
(2)反应过程中部分二价铁转化成了三价铁 向溶液D中加入足量铁粉,反应后过滤,取滤液蒸发结晶即可得绿矾
(3)Cu+H2O2+H2SO4=CuSO4+2H2O
(4)更合理 因为前一种方案操作步骤多、时间长、消耗试剂量过大
本题解析:(1)过滤属于基本操作,玻璃仪器有烧杯、漏斗、玻璃棒。
(2)Fe2+很容易被空气中的氧气氧化为Fe3+,加入足量铁粉于溶液中,就可以使Fe3+转化为Fe2+,从而使滤液蒸发结晶即可得绿矾。
(3)稀H2SO4不能直接氧化Cu,加入氧化性的H2O2可氧化。
(4)实验评价在于比较,一般是从试剂成本、反应时间(生产效率)等方面思考,故后者更合理。
本题难度:一般
5、选择题 14g铜银合金跟足量的某浓度HNO3反应,将放出的气体与1.12LO2(标况)混合,通入水中,恰好全部吸收,则合金中铜的质量是
A.1.6g
B.3.2g
C.6.4g
D.9.6g
参考答案:B
本题解析:金属和硝酸反应,金属失去电子,硝酸被还原。由于硝酸的还原产物和氧气反应又生成硝酸,这说明金属失去的电子相当于被氧气获得,氧气的物质的量是1.12L÷22.4L/mol=0.05mol,得到0.05mol×4=0.2mol电子。设铜的物质的量是x、银是y,则64x+108y=14g、2x+y=0.2mol,解得x=0.05mol,y=0.1mol。所以铜的质量是3.2g,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题,试题侧重对硝酸能力的考查。该题的关键是明确金属失去的电子转移到氧气中,然后依据电子的得失守恒列式计算即可。
本题难度:简单