稀氨水
参考答案:C
本题解析:A选项中盐酸能除去SO23-,不影响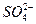 的检验。B选项中AgCl为白色沉淀,AgI为黄色沉淀,故Cl-的存在不影响I-的检验。C选项中Fe3+与SCN-反应使溶液变血红色,干扰Fe2+的检验。D选项中氨水过量时Ag+转为[Ag(NH3)2]+,Al3+转化为Al(OH)3白色沉淀,故Ag+的存在不影响Al3+的检验。 的检验。B选项中AgCl为白色沉淀,AgI为黄色沉淀,故Cl-的存在不影响I-的检验。C选项中Fe3+与SCN-反应使溶液变血红色,干扰Fe2+的检验。D选项中氨水过量时Ag+转为[Ag(NH3)2]+,Al3+转化为Al(OH)3白色沉淀,故Ag+的存在不影响Al3+的检验。
本题难度:简单
2、选择题 下列四个化学反应中,符合此漫画情景的是(?)?

A.H2+CuO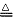 Cu+H2O Cu+H2O
B.CuO+CO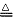 Cu+CO2 Cu+CO2
C.Fe+H2SO4=FeSO4+H2↑
D.Fe+CuSO4=FeSO4+Cu
参考答案:D
本题解析:略
本题难度:简单
3、计算题 将12.8克由CuSO4和Fe组成的固体,加入足量的水中充分反应后,滤出固体,干燥后称得5.2克。求原混合物中CuSO4和Fe各为多少克?
参考答案:CuSO4为8克,Fe为4.8克
本题解析:此题有三种反应可能:恰好完全反应、CuSO4过量、Fe过量。
余下固体有两可能:(1)余下Fe和Cu;(2)余下全是Cu.
(1)当余下固体是Fe和Cu(即Fe过量)时,设x克CuSO4耗尽,则铁为(12.8-x)克,置换差量为5.2-(12.8-x)克。
CuSO4 + Fe 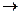 ?FeSO4 +Cu?固体增重 ?FeSO4 +Cu?固体增重
160? 56? 64? 64-56=8(理论差量)
x? 5.2-(12.8 -x)(实际差量) -x)(实际差量)
160:x=8:[5.2-(12.8-x)]
∴? x=8(克),12.8-x=4.8(克)。
(2)设余下固体全是Cu,反应时有w克Fe耗尽。
CuSO4 + Fe 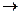 ?FeSO4+ Cu?固体增重 ?FeSO4+ Cu?固体增重
56? 64? 64-56=8(理论差量)
 ?W? 5.2-w(实际差量) ?W? 5.2-w(实际差量)
56:w=8:5.2-w
∴? w=4.55(克),
则原混合物中CuSO4为12.8-4.55=8.25(克)。
而8.25克CuSO4中只含8.25× =3.3(克)Cu,故不可能有5.2克Cu生成。由此可见(2)的假设不成立。 =3.3(克)Cu,故不可能有5.2克Cu生成。由此可见(2)的假设不成立。
本题难度:简单
4、简答题 某研究性学习小组用不纯的氧化铝(杂质为Fe2O3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):
(1)试剂X的化学式为______,反应I的离子方程式是______.
实验室配制480mL?1mol?L-1?X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有______.常用来可以标定所配X的溶液浓度是否准确的实验名称是______.
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3].从实际工业的角度,你认为方案______更合理,理由是______
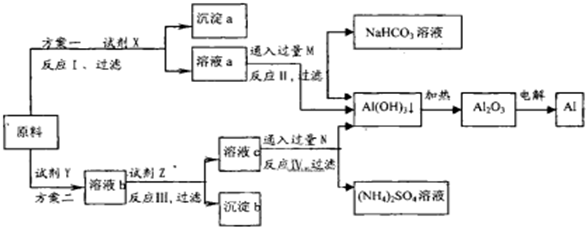
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验.
①仪器A的名称是______,装置中A口部和B口部之间联通导气管的作用是______
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的______(填字母序号).
A.生石灰?B.烧碱?C.胆矾?D.碱石灰
(4)若D中事先滴入少量酚酞,则C中液体呈______色,用离子方程式解释原因______.
参考答案:(1)方案一:由溶液a通入过量的M生成氢氧化铝沉淀、碳酸氢钠可知,溶液a中含有偏铝酸根、气体M为二氧化碳,故试剂X为NaOH溶液,反应I为氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL1mol?L-1?NaOH的溶液需要玻璃仪器有:烧杯、玻璃棒、试剂瓶、胶头滴管、500mL容量瓶,故缺少500mL容量瓶,
可以利用中和滴定方法以标定所配NaOH溶液浓度是否准确;
故答案为:NaOH;Al2O3+2OH-═2AlO2-+H2O;500mL容量瓶;中和滴定;
(2)方案二:由溶液c通入过量的N生成氢氧化铝沉淀、硫酸铵可知,溶液c中含有铝离子、N为氨气,故试剂Y为硫酸,溶液b中含有硫酸铝、硫酸铁,调节PH值,是铁离子转化为氢氧化铁,过滤后,再向滤液中加入过量的氨水沉淀铝离子,
与方案一相比较,方案一步骤少,操作简单,故方案一更合理,
故答案为:方案一;步骤少,操作简单;
(3)①、仪器A是分液漏斗,装置中A口部和B口部之间联通导气管的作用是:平衡分液漏斗内外压强,防止分液漏斗堵塞;
②、A中盛有浓氨水,与生石灰、烧碱、碱石灰混合,放出大量的热,溶液中氢氧根离子浓度增大,利用氨气逸出,产生大量的氨气,氨水与胆矾反应生成氢氧化铜沉淀,不能产生氨气,故C不能可以,
故答案为:C;
(4)氨气溶于水,反应生成一水合氨,一水合氨电离出氢氧根,NH3+H2O?NH3?H2O?NH4++OH-,溶液呈碱性,酚酞在碱性条件下呈红色,
故答案为:红;NH3+H2O?NH3?H2O?NH4++OH-.
本题解析:
本题难度:一般
5、选择题 向某晶体的水溶液中加入含Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合液出现红色,那么由此得出的下列结论,错误的是
[? ]
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+被Br2氧化为Fe3+
D.Fe2+与SCN-不能形成红色的化合物
参考答案:B
本题解析:
本题难度:简单
|