1、实验题 实验室用 98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的 H2SO4溶液950mL.
(1)需要使用的主要仪器有量筒、烧杯、玻棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D)→( A )→( C )→( )→( )→( )→( F )。
③容量瓶在使用前必须进行的操作是 。
④将浓硫酸在烧杯中稀释后移入容量瓶时,必须_____________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会 ;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会 ;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度,所配溶液浓度会 .
④容量瓶未干燥即用配制溶液 .
⑤往容量瓶转移时,有少量液体溅出 .
参考答案:(1)1000ml容量瓶 胶头滴管;(2)①10.9ml ;② B E G ;③检查是否漏液;④冷却到室温;(3)①偏低 ②偏高 ③偏低 ④无影响 ⑤偏低
本题解析:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤后并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后盖好瓶塞颠倒摇匀.故所用仪器还有1000mL容量瓶、胶头滴管.
故答案为:1000mL容量瓶、胶头滴管.(2) 98%、密度为1.84g/cm3的浓硫酸的浓度为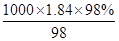 =18.4mol/L根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=1000mL×0.2mol/L,解得:x≈10.9,所以应量取的硫酸体积是10.9mL.故答案为:10.9.②配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤后并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后盖好瓶塞颠倒摇匀.所用操作顺序为D→A→C→B→E→G→F.
=18.4mol/L根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=1000mL×0.2mol/L,解得:x≈10.9,所以应量取的硫酸体积是10.9mL.故答案为:10.9.②配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤后并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后盖好瓶塞颠倒摇匀.所用操作顺序为D→A→C→B→E→G→F.
故答案为:B→E→G.③浓硫酸稀释放出大量热,溶液具有热胀冷缩的性质,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,会导致溶液体积偏小,溶液浓度偏大.故应将溶液冷却到室温后转移1000mL容量瓶中.故答案为:将溶液冷却到室温后(3)①量取浓硫酸时眼睛俯视刻度线,使量取硫酸溶液的体积偏低,所以溶液浓度偏低;故答案为:偏低.②定容时,眼睛俯视刻度线,使溶液的体积偏低,所配溶液浓度会偏高.故答案为:偏高.③摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所配溶液浓度会偏低.故答案为:偏低.
考点:溶液的配制
本题难度:一般
2、实验题 (7分)⑴用18mol/L浓硫酸配制100mL 1.0mol/L的稀硫酸,若实验仪器有:
A.100mL量筒 B.玻璃棒 C.托盘天平 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
实验时必须选用的仪器是(填入字母)
⑵在配制过程中,下列操作不正确的是 A.使用容量瓶前需检查它是否漏水
B.容量瓶用蒸馏水洗净后,一定要干燥后再使用
C.配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线
D.定容后盖好瓶塞,反复上下颠倒,摇匀
⑶若实验时遇到下列情况,将使所配溶液的浓度 (填“偏高”、“偏低”或“无影响”)
A.定容时俯视读数
B.未将洗涤液转入容量瓶
C.洗涤量筒,并将洗涤液转入容量瓶
参考答案:(1)BEFGH (2)BC (3)偏高 偏低 偏高
本题解析:(1)由溶液配制一定物质的量浓度的溶液需要的仪器有:玻璃棒、100mL容量瓶、10mL量筒,胶头滴管、50mL烧杯。因此选BEFGH。
(2)容量瓶不需要干燥使用,B项错误,定容操作应该用胶头滴管,C项错误。
(3)根据c=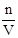 ,定容时俯视刻度,溶液的体积小于正常值,浓度偏高;未将洗涤液转入容量瓶,溶质的物质的量小于正常值,浓度偏低;洗涤量筒并将洗涤液转入容量瓶,溶质的物质的量大于正常值,浓度偏高。
,定容时俯视刻度,溶液的体积小于正常值,浓度偏高;未将洗涤液转入容量瓶,溶质的物质的量小于正常值,浓度偏低;洗涤量筒并将洗涤液转入容量瓶,溶质的物质的量大于正常值,浓度偏高。
考点:物质的量浓度溶液的配制
点评:本题非常基础简单,主要考查学生的实验能力和分析能力。
本题难度:一般
3、简答题 50g物质的量浓度为C1的浓H2SO4,质量分数为W1,与体积为V的水混合后得到物质的量浓度为C2的稀H2SO4,质量分数为W2(以下填“>”“<”或“=”)
(1)若W1=2W2,则C1______2C2,V______50mL.
(2)若C1=2C2,则W1______2W2,V______50mL.
参考答案:(1)设物质的量是浓度为c1?mol?L-1的密度为ρ1,物质的量是浓度为c2mol?L-1硫酸溶液的密度为ρ2,则
c1=1000ρ1W198,c2=1000ρ2W298
所以c1c2=ρ1W1ρ2W2,由于W1=2W2,所以c1c2=ρ1W1ρ2W2=2ρ1ρ2,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以c1>2c2;
设物质的量是浓度为c2mol?L-1硫酸溶液的质量为m,则
50g×W1=m×W2,所以稀释后硫酸溶液的质量m=50W1W2g,所以加入水的质量为50W1W2g-50g,由于W1=2W2,所以加入水的质量为50W1W2g-50g=50g,所以水的体积V=50g1g/ml=50ml.
故答案为:>;=.
(2)设物质的量是浓度为c1?mol?L-1的密度为ρ1,物质的量是浓度为c2mol?L-1硫酸溶液的密度为ρ2,则
由c=1000ρωM可知,W1=98c11000ρ1,W2=98c21000ρ2
所以W1W2=c1ρ2c2ρ1,由于C1=2C2,所以W1W2=c1ρ2c2ρ1=2ρ2ρ1,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以W1<2W2;
设物质的量是浓度为c2mol?L-1硫酸溶液的质量为n,则
50g×W1=n×W2,所以稀释后硫酸溶液的质量n=50W1W2g,所以加入水的质量为50W1W2g-50g,由于W1<2W2,所以加入水的质量为50W1W2g-50g<50g,所以水的体积V<50g1g/ml=50ml.
故答案为:<;<.
本题解析:
本题难度:一般
4、选择题 阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是(?)
A.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移约0.2×6.02×1023个电子
B.25℃时,1 L pH=13的NaOH溶液中约含有6.02×1023个氢氧根离子
C.1 mol羟基所含的电子数约为9×6.02×1023
D.在标准状况下,22.4 L辛烷中所含分子数为NA
参考答案:AC
本题解析:B错,1 L pH=13的NaOH溶液中含有0.1moLOH-,D错,标准状况下,辛烷是液体。
本题难度:简单
5、选择题 将一定量的金属钠放入一定物质的量浓度的NaOH溶液中,反应完成后,NaOH溶液的物质的量浓度?(?)
A.增大
B.不能确定
C.减少
D.不变
参考答案:B
本题解析:选B
当原NaOH溶液是饱和溶液时,反应后浓度不变;当原NaOH溶液是不饱和溶液时,反应后浓度增大。
本题难度:简单