1、选择题 下列实验操作正确的是( )
A.测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润
B.蒸馏时,将温度计的水银球插入蒸馏烧瓶中液面以下
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.中和滴定时,锥形瓶必须洗净并烘干后才能使用
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
[? ]
实验操作?
实验目的或结论
A.
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊
的无色无味气体
说明该钾盐是K2CO3
B.
向含有少量FeCl3的CuCl2溶液中加入足量Cu粉,
搅拌一段时间后过滤
除去CuCl2溶液中少量FeCl3的,
提纯CuCl2溶液
C.
常温下,向饱和Na2CO3溶液中通入过量CO2,
溶液变浑浊
说明常温下NaHCO3溶解度比
Na2CO3溶解度小
D.
C2H5OH与浓硫酸在170℃共热,将制得的气体
直接通入酸性KMnO4溶液
检验制得气体是否为乙烯
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列各项中“操作或现象”能达到预期“实验目的”的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A.二氧化硫和二氧化碳都能使澄清石灰水变浑浊;
B.在蛋白质溶液中加入硫酸钠溶液,发生盐析,不是变性;
C.将少量溴乙烷与NaOH溶液混合共热,水解生成NaCl和乙醇,酸化后可检验溴离子;
D.KSCN溶液不足,不能证明存在平衡.
解答:A.碳与浓硫酸在加热条件下反应生成二氧化硫和二氧化碳,如先通过澄清石灰水,则二则都能使石灰水变浑浊,不能证明,故A错误;
B.在蛋白质溶液中加入硫酸钠溶液,发生盐析,不是变性,故B错误;
C.将少量溴乙烷与NaOH溶液混合共热,水解生成NaCl和乙醇,充分反应并冷却后,向上层清液中加稀HNO3酸化,再滴加AgNO3溶液,可观察到浅黄色沉淀生成,可证明,故C正确;
D.KSCN溶液不足,不能证明存在平衡,应使二者恰好反应后再检验,故D错误.
故选C.
点评:本题考查化学实验方案的评价,侧重于基本实验的操作的考查,涉及物质的检验和平衡移动的问题,题目难度不大,注意把握相关基础知识.
本题难度:困难
4、选择题 海藻中含有丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程的一部分。
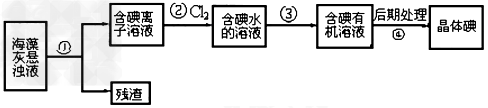
下列判断正确的是
[? ]
A.步骤①、③的操作分别是过滤、萃取?
B.可用淀粉溶液检验步骤②的反应是否进行完全 ?
C.步?骤③中加入的有机溶剂是裂化汽油或乙醇 ?
D.步骤④的操作是过滤
参考答案:A
本题解析:
本题难度:一般
5、简答题 为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
【方案I】
(1)组装发生并测定生成气体体积的实验装置,并检验气密性;
(2)称取碳酸钙样品Wg;
(3)加入过量盐酸;
(4)收集并测定生成的气体体积VmL.
问题I-1:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会______(填“偏高、偏低、无影响”).
问题I-2:在方框中画出测定生成的气体体积的装置简图.
【方案II】
(1)称取碳酸钙样品Wg;
(2)在锥形瓶中用Cmol/L盐酸VmL(过量)溶解样品;
(3)加入甲基橙作指示剂,再用浓度为C1mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升.(已知甲基橙的变色范围是pH=3.1~4.4)
问题II-1:未滤去不溶物SiO2,对测定结果是否有影响?(填有或无)______;
理由是______.
问题II-2:碳酸钙纯度表达式______.
【方案评价】
你认为以上两个方案中,最好的方案是______,
另一个方案不够好的理由是______.

参考答案:【方案Ⅰ】、问题I-1如果称量样品时,砝码底部有一处未被实验者发现的残缺,依据天平称量原理分析,砝码质量减小,称量出物质的质量减小,所以那么测定的碳酸钙的纯度会偏低;
故答案为:偏低;
问题I-2;测定生成的气体体积的装置是测定反应生成二氧化碳气体的条件,可以利用排饱和碳酸氢钠溶液的方法测定,导气管短进长出装置图为: ;
;
故答案为: ;
;
【方案Ⅱ】问题II-1:酸碱中和反应终点是利用指示剂甲基橙变色确定,甲基橙的变色范围是pH=3.1~4.4,滴定终点为弱酸性,不能溶解二氧化硅,二氧化硅不与氢氧化钠溶液反应,不需要过滤;
故答案为:无,甲基橙变色时,溶液呈弱酸性,此时SiO2不会与氢氧化钠溶液发生反应;
问题II-2:称取碳酸钙样品Wg,在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品,加入甲基橙作指示剂,再用浓度为C1mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升,所以溶解碳酸钙需要的氯化氢物质的量=Cmol/L×V×10-3L-C1mol/L×V1×10-3L,CaCO3+2HCl=CaCl2+H2O+CO2↑,则碳酸钙物质的量=0.5(Cmol/L×V×10-3L-C1mol/L×V1×10-3L),碳酸钙纯度=(CV-C1V1)×10-3×0.5×100W×100%=0.05(CV-C1V1)W×100%;
故答案为:0.05(CV-C1V1)W×100%;
【方案评价】对比实验方案,分析判断方案Ⅱ测定结果更准确;方案Ⅰ中气体体积难于准确测定,实验操作复杂,不易准确测定;
故答案为:方案II,测量生成的CO2的体积操作较繁琐,误差较大;计算时还需将其折算成标准状况时的体积,比较复杂.
本题解析:
本题难度:一般