1、选择题 下列操作不能达到实验目的的是
[? ]
A.证明硫酸钠溶液中混有氯化钠用硝酸银溶液
B.用KMnO4固体和浓盐酸共热制Cl2
C.用KMnO4溶液除去CO2气体中的SO2气体
D.将烧黑的铜丝插入酒精灯火焰的焰心后,铜丝又变光亮
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列实验操作与实验目的或所得实验结论一致的是
[? ]
实验操作
实验目的或结论
A.
某溶液做焰色反应,现象为黄色
说明该溶液中不存在钾离子
B.
测某烷烃只有一个沸点
说明该烷烃不存在同分异构体
C.
常温下,向刚形成的AgCl沉淀中加
入NaBr溶液,沉淀变黄色
说明Ksp(AgBr)<Ksp(AgCl)
D.
向某盐溶液中加入盐酸,有无色不
能使品红溶液褪色的气体产生
说明该盐是碳酸盐
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列应用化学科学对物质进行研究的基本方法或所得的结论,不正确的是
A.焰色反应实验,若火焰呈黄色,不能确认是否含有钾元素
B.根据CO2和SiO2都是酸性氧化物,推知两者物理性质相似
C.根据电解质在水溶液中能否完全电离,将电解质分为强电解质与弱电解质
D.测定物质的量浓度相同的NaA和NaB溶液的PH,可以比较对应酸的酸性强弱
参考答案:B
本题解析:分析:A.焰色反应实验若火焰呈黄色说明含有钠元素;
B.CO2是气体,SiO2是固体;
C.根据电解质在水溶液中能否完全电离,将电解质分为强电解质与弱电解质;
D.弱酸的阴离子水解显碱性.
解答:A.焰色反应实验若火焰呈黄色说明含有钠元素,钾或含K+的化合物焰色反应为浅紫色(透过钴玻璃),故A正确;
B.尽管CO2和SiO2都是酸性氧化物,CO2是气体,SiO2是固体,二者物理性质不同,故B错误;
C.强电解质和弱电解质的划分是看在水中是否能够完全电离,根据电解质在水溶液中能否完全电离,将电解质分为强电解质与弱电解质,故C正确;
D.弱酸的阴离子水解显碱性,酸性越弱,碱性越强,故D正确.
故选B.
点评:本题考查焰色反应,强弱电解质,盐类的水解,注意掌握盐类水解的规律.
本题难度:一般
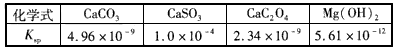
4、实验题 某研究性学习小组对粗盐的提纯和检验进行研究,他们查得有关资料如下表所示。
【有关资料】
【设计除杂过程】
已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下。
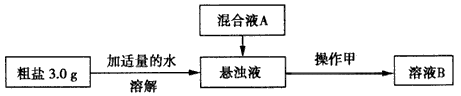
(1)操作甲的名称为___,若在操作甲结束后发现溶液B略有浑浊,应采取的措施是___。
(2)混合液A的主要成分是___(填化学式)。
【检验除杂效果】
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验。
步骤一:检验Mg2+是否除尽。向其中一支试管中加入___溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入“某溶液”,看是否有沉淀生成。“某溶液” 中的溶质选用下列选项中的__(填字母序号)时检验效果最佳。
A.Na2CO3
B.Na2SO3
C.Na2C2O4
【获取纯净食盐】
(4)对溶液B加热并不断滴加6 mol.L-1的盐酸,同时不断用pH试纸检测溶液的pH,直至pH =2 时停止加盐酸,得到溶液C。该操作的目的是____。
(5)将溶液C倒入___(填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到蒸发皿中有大量同体析出时停止加热。
【问题讨论】
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是____,该操作中控制 溶液的pH =12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+的物质的量浓度将被控制在____以下。
参考答案:(1)过滤 ;更换过滤器并重新进行过滤操作?
(2) NaOH、Na2CO3
(3)NaOH;C
(4)除去OH -和CO32-
(5)蒸发皿
(6)加快沉淀的生成;5.61×10-8 mol.L-1
本题解析:
本题难度:困难
5、填空题 Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.
实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(1)制备MnSO4溶液:
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
①石灰乳作用______.
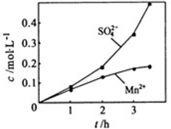
②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是______.
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7,请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①______;②______;③检验SO42-是否被洗涤除去;④______;⑤低于100℃干燥.
Ⅱ锌铝合金的主要成分有Zn、Al、Cu、Si等元素.实验室测定其中Cu含量的步骤如下:
①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于
250mL容量瓶中.
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,
用0.01100mol?L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3溶液6.45mL.
(1)判断步骤②滴定终点的方法是______.
(2)计算合金中Cu的质量分数______.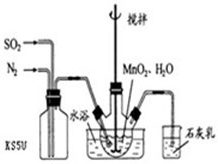
参考答案:Ⅰ(1)①石灰乳与氯气发生反应:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,石灰乳除去未反应氯气,防止氯气污染空气,故答案为:除去未反应氯气,防止氯气污染空气;
②空气中含有氧气,O2与H2SO3反应生成H2S04,所以反应液中SO42-的浓度随反应时间增大更多,
故答案为:O2与H2SO3反应生成H2S04;
(2)用MnSO4溶液制备高纯MnCO3的操作步骤为:
①边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7;
②过滤,用少量水洗涤2~3次;
③检验SO42-是否被洗涤除去;
④用少量C2H5OH洗涤;
⑤低于100℃干燥,可得高纯MnCO3.
故答案为:边搅拌边加入NaHCO3(Na2CO3),并控制溶液pH<7.7;过滤,用少量水洗涤2~3次;用少量C2H5OH洗涤;
Ⅱ(1)淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变,说明滴定到达终点,
故答案为:淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去,半分钟颜色不变;
(2)由②可知发生反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,
根据关系式2Cu~~~~~~2Cu2+~I2~~~~2S2O32-,
? ? 2? 2
?n(Cu)?0.01100mol/L×6.45×10-3L×5
所以?n(Cu)=0.01100mol/L×6.45×10-3L×5=5.5×6.45×10-5mol,
合金中Cu的质量分数为5.5×6.45×10-5mol×64g/mol1.1g×100%=2.064%,
故答案为:2.064%.
本题解析:
本题难度:一般