1、选择题 下列混 合物,能用分液漏斗进行分离的是
合物,能用分液漏斗进行分离的是
A.水与酒精
B.水与植物油
C.水与醋酸

D.水与蔗糖
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列分离或提纯物质的方法错误的是( )
A.用渗析的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
参考答案:A、胶体的微粒直径在1nm~100nm之间,不能透过半透膜,可用渗析的方法分离,故A正确;
B、碳酸氢钠加热时易分解,生成碳酸钠和水,所以可用加热的方法提纯含有少量碳酸氢钠的碳酸钠,加热时水挥发,没有引入其它杂质,故B正确;
C、硫酸钡和碳酸钡都难溶于水,不能用溶解、过滤的方法分离,应加入盐酸,充分反应后过滤、洗涤,故C错误;
D、蛋白质在轻金属盐溶液中的溶解度变小,可用盐析的方法分离,故D正确.
故选C.
本题解析:
本题难度:一 般
3、填空题 (12分)化学是一门以实验为基础的自然科学。
(1)下列说法中,符合实验安全规范要求的是?(填序号字母)。
① 闻气体的气味时,应用手在瓶口轻轻煽动,使少量的气体飘进鼻孔
② 在实验室做铜和浓硝酸反应制备二氧化氮的实验时,应该在通风橱中进行
③做H2还原CuO实验时,先加热CuO至高温,然后立即通入H2使反应发生
④实验中当有少量的过氧化钠剩余时,用纸包裹好后将其放入垃圾桶中
(2)某学习小组用右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应及部分产物的性质(装置中的铜丝可适当上下抽动)。
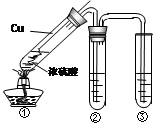
① 当反应进行一段时间后,欲使反应迅速停止,可采取的措施为?。
② 若装置②用来检验生成的气体产物的性质,在装置②的试管中加入的试剂为品红试液,通入气体后,现象为?,此现象证明该气体产物具有?性。
③ 装置③中盛有某单质的水溶液,用来检验气体产物的还原性,则该单质的水溶液为
?,反应的化学方程式为?。
④ 实验最后,要将图①大试管中的液体与水混合,以观察颜色检验存在的离子,从安全角度考虑,混合的方法应该是?。
⑤ 实验中,在所用仪器及仪器间连接都完好的情况下,同学们仍闻到了较强的刺激性气味,说明此实验的整套装置设计有缺陷,会造成空气污染。改进此实验装置的方法是?。
参考答案:(共12分)(1)(2分)①②
(2)(10分)①向上(向外)抽动铜丝,使铜丝脱离浓硫酸(1分);
②品红试液退色(1分),漂白性(1分);
③氯水(或溴水、碘水)(1分),Cl2 + SO2 + 2H2O =" 2HCl" + H2SO4(2分);
④将①中大试管中冷却后的部分液体沿烧杯内壁缓慢注入盛有适量水的烧杯中,并不断搅拌(2分);
⑤ 在装置③处连一个装有NaOH溶液的洗气瓶,以吸收有毒尾气(2分)
本题解析:(1)有些气体具有毒性,例如NO2,所以应该在通风厨中进行,选项①②正确。氢气是可燃性气体,应该先进行纯度的检验,③不正确;过氧化钠具有强氧化性,且极易和水反应生成氢氧化钠和氧气,不能随意丢弃,④错误,答案选①②。
(2)①根据装置的特点可知,欲使反应迅速停止,可采取的措施是向上(向外)抽动铜丝,使铜丝脱离浓硫酸即可。
②铜和浓硫酸在加热的条件下,发生反应生成SO2,SO2具有漂泊性,能使品红溶液褪色。
③SO2具有还原性,而氯水或溴水以及碘水都有氧化性,SO2能使它们褪色,所以检验SO2的还原性时,可以利用氯水(或溴水、碘水)。
④由于大试管中还有浓硫酸,而浓硫酸溶于水会放出大量的热,所以正确的做法是将①中大试管中冷却后的部分液体沿烧杯内壁缓慢注入盛有适量水的烧杯中,并不断搅拌。
⑤由于SO2属于大气污染物,所以必须有尾气处理装置,即在装置③处连一个装有NaOH溶液的洗气瓶,以吸收有毒尾气。2的性质、检验以及尾气处理等
点评:该题是高考中的常见题型,属于中等难度的试题,试题贴近高考,基础性强,学生不难得分。该题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
4、选择题 从物质的量浓度为1.0 mol/L的NaOH溶液2 L中取出200 mL,下列关于这200 mL溶液的叙述中正确的是
A.NaOH的物质的量浓度为1.0 mol/L
B.含NaOH1 g
C.物质的量浓度为0.1 mol/L
D.含NaOH0.1 mol
参考答案:A
本题解析:
本题难度:简单
5、选择题 关于下列各实验装置的叙述中,不正确的是( )
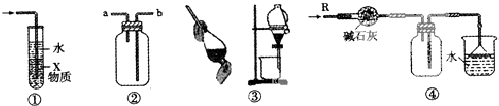
A.装置①中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③可用于分离C2H5OH和H2O的混合物
D.装置④可用于干燥、收集NH3,并且吸收对于的NH3
参考答案:C
本题解析:
本题难度:简单