蒸馏
参考答案:D
本题解析:A选项中浓硫酸具有强氧化性和酸性,而NH3是一种还原性气体,同时也是一种碱性气体,要与浓硫酸发生反应。B选项中浓溴水中的溴会溶解与苯中,不能采用过滤的方法除去。C选项中氯水会氧化溴化钠中的溴,影响了被提纯的物质。
本题难度:一般
2、选择题 100mL0.3mol·L-1Na2SO4溶液和50mL0.2mol·L-1Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度(设体积为二者之和)为
A.0.2mol?L-1
B.0.25 mol?L-1
C.0.4 mol?L-1? ?
D.0.5 mol?L-1
参考答案:C
本题解析:试题分析:n(SO42-)=0.1×0.3mo·L-1+0.05L×3×0.2mol·L-1=0.06mol.C(SO42-)="n/V=0.06mol/0.15L=0.4" mol/L.选项为:C
考点:考查混合溶液中微粒的物质的量浓度的计算的知识。
本题难度:简单
3、实验题 (8分)测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨?②称量空坩埚和装有试样的坩埚的质量?③加热?④冷却?⑤称量⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1 g为止?⑦根据实验数据计算硫酸铜晶体里结晶水的含量。
请回答下列问题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是
____________________________________________。
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?答:
____________________________________________。
(3)实验步骤⑥的目的是________________________________________________________。
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号):_______________________。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
参考答案:(1)研钵、托盘天平、酒精灯(答与不答火柴、不给分也不扣分)?(2)④;冷却、防止吸水?(3)检验样品中的结晶水是否已经全部除去?(4)AC
本题解析:此题来源于高中化学教材中的一个学生实验。通过此实验考查了学生的基本实验素质,同时也考查了学生的综合分析和推理能力以及文字表达能力。
此题的设计正符合高考的要求“来源于教材但不拘泥于教材”。这就要求考生平时对课本中的各个实验有一定的认识与掌握。
本题难度:简单
4、选择题 某同学想用实验证明高锰酸钾的紫红色是MnO4-的颜色,而不是K+的颜色,他设计了以下实验方案。请你判断下列方案与本实验目的无关的是(? )
A.观察氯化钾溶液没有颜色,表明溶液中的K+无色
B.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应
C.在高锰酸钾溶液中加入适量锌粉、振荡、静置后紫红色褪去,表明MnO4-为紫红色
D.将高锰酸钾晶体加热分解,所得的固体质量减轻
参考答案:D
本题解析:证明高锰酸钾的紫红色是MnO4-的颜色,而不是K+的颜色,可选择其他离子的钾盐溶液,观察颜色,与其他物质能否反应,再选择MnO4-,观察颜色,与其他物质反应后观察颜色,只有选项D与本实验目的无关。
本题难度:一般
5、选择题 NA表示阿伏加德罗常数的值,下列说法中正确的是
A.2L0.5mol?L-1的NH4Cl溶液中含有NA个NH4+
B.18g?D2O中含有10NA个电子
C.1molNa2O2与足量的水反应生成O2转移NA个电子
D.32gO2和O3的混合物中含有的原子总数一定是2NA个
参考答案:CD
本题解析:分析:A.NH4+水解;
B.根据n=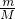 = =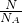 结合原子的构成判断; 结合原子的构成判断;
C.根据反应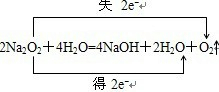 判断; 判断;
D.32gO2和O3的混合物组成原子都为O,根据n=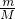 = =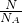 计算. 计算.
解答:A.NH4+水解,2L0.5mol?L-1的NH4Cl溶液中NH4+的个数小于NA,故A错误;
B.n=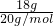 =0.9mol,则18gD2O中含有9NA个电子,故B错误; =0.9mol,则18gD2O中含有9NA个电子,故B错误;
C.由反应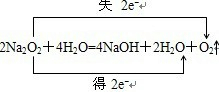 可知,1molNa2O2与足量的水反应生成O2转移NA个电子,故C正确; 可知,1molNa2O2与足量的水反应生成O2转移NA个电子,故C正确;
D.32gO2和O3的混合物组成原子都为O,n(O)=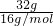 =2mol,则原子总数一定是2NA个,故D正确. =2mol,则原子总数一定是2NA个,故D正确.
故选CD.
点评:本题考查阿伏加德罗常数,题目难度不大,本题注意物质的性质、原子结构和组成等问题,为该题的主要考查点,也是易错点.
本题难度:一般
|