1、选择题 下列叙述中错误的是?
[? ]
A.原子半径:Cl>S>O?
B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr?
D.酸性:HClO4>H2SO4>H3PO4
参考答案:A
本题解析:
本题难度:一般
2、选择题 由中科院等离子体物理研究所设计、研制的“人造小太阳”能够像太阳一样为人类提供无限、安全、清洁的能源,它是利用海水中氢的同位素氘(21H)的聚变反应产生能量.下列有关氘(21H)的说法正确的是(? )
A.氘原子核内有2个中子
B.氘原子核外有2个电子
C.比氢原子多1个质子
D.比氢原子多1个中子
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列说法正确的是( )
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
参考答案:B
本题解析:
本题难度:简单
4、填空题 已知A、B、C、D是短周期中的四种非金属元素,它们的原子序数依次增大,四种元素的原子最外层电子数之和为16,A与B、C、D之间均可形成含有10个电子或18个电子的化合物,且A、D组成的化合物在常温下呈液态。
(1)A、C两种元素组成的10个电子化合物的分子的空间构型是_________,属于________(填极性、非极性)分子。
(2)B单质在高温下可从A与D组成的某种化合物中置换出A,同时生成化合物BD,该反应的化学方程式为____________________。
(3)A、C、D三种元素原子半径由小到大的顺序是(用元素符号表示)__________;由A与C、 A与D构成的两种分子,结合H+的能力________强(填化学式),用离子方程式表示这一事实:__________。
(4)A、B、D三种元素形成的具有18个电子的化合物的结构简式为__________。
(5)这四种元素可组成原子个数比为5:1:1:2(按A、B、C、D顺序)的化合物,其名称为_________。
参考答案:(1) 三角锥形;极性
(2)
(3)H,O,N ;NH3
NH3+H3O+==NH4++H2O
(4)CH3OH
(5)甲酸铵
本题解析:
本题难度:困难
5、填空题 下面列出了几组物质,请将物质的合适组号填写在空格上.
①金刚石与“足球烯”C60;?②氧气(O2)与臭氧(O3);③16O、17O和18O;?⑤乙烯和乙烷;
⑥
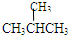
?和?
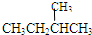
;⑦
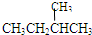
?和?
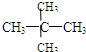
;
(1)同位素______,
(2)同系物______,
(3)同分异构体______.
参考答案:(1)质子数相同而中子数不同的同一元素的不同原子互称为同位素,根据同位素概念可知16O、17O和18O互称同位素.①②均属于同素异形体.
(2)同系物是对有机物而言.在分子组成上相差一个或若干个CH2原子团的物质互称同系物.分析④⑤⑥⑦可知,符合同系物概念的只有④⑥.⑤仅是碳原子数相同.
(3)同分异构体是指分子式相同而结构式不同的有机物.⑤仅是碳原子数相同,而氢原子数不同.⑦不仅碳原子数相同,而且氢原子数相同,结构还不一样,即
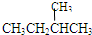
和
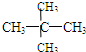
属于同分异构体.
故答案为:
(1)③
(2)④⑥
(3)⑦
本题解析:
本题难度:一般