| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《物质的量》考点预测(2019年强化版)(十)
参考答案:D 本题解析:3.2gSO2的物质的量是3.2g÷64g/mol=0.05mol,则含有生物氧原子是0.05mol×2=0.1mol,则NO2的物质的量是0.1mol÷2=0.05mol,其质量是0.05mol×46g/mol=2.3g,答案选D。 本题难度:简单 4、填空题 (10分)按要求填空: |
参考答案:(1)②⑥⑦?(2)2.24?(3)加热或升华?
(4)正确的操作顺序是: D → E →? I ?→ C → ?B??→ ?F??→ A
(前3小题各2分,第4小题每空1分共4分)
本题解析:(1)溶于水或在熔融状态下能够电离出离子的化合物是电解质,溶于水和在熔融状态下都不能够电离出离子的化合物是非电解质,据此可知,氨气、酒精是非电解质,碳酸钙、氢氧化钾和氯化氢是电解质,饱和食盐水是混合物,铜是单质,不是电解质也不是非电解质,答案选②⑥⑦。
(2)14.7gH2SO4分子的物质的量=14.7g÷98g/mol=0.15mol,其中氢原子的物质的量是0.15mol×2=0.30mol。由于与NH3所含氢原子数相等,则氨气分子中氢原子的物质的量也是0.3mol,因此氨气的物质的量=0.30mol÷3=0.1mol,因此氨气在标准状况下的体积=0.1mol×22.4L/mol=2.24L。
(3)单质碘易升华,因此除去氯化钠中单质碘的实验方法是加热升华。
(4)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此正确的顺序是D → E →? I?→ C →? B?→? F?→ A。
本题难度:一般
5、选择题 向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH(aq),生成沉淀的质量与滴入NaOH(aq)的体积关系如图。原混合溶液中MgCl2与FeCl3的物质的量之比为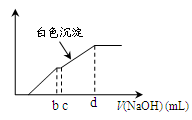
A.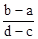
B.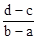
C.
D.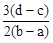
参考答案:D
本题解析:向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,首先发生反应NaOH+HCl=NaCl+H2O,即为图象中0-amL,沉淀的质量为0g;FeCl3只能在酸性较强的溶液中存在,当酸性减弱时,会转化为Fe(OH)3沉淀,从amL开始,bmL时沉淀完全.bmL时,溶液仍然呈酸性,到cmL时,才开始产生Mg(OH)2沉淀,令氢氧化钠浓度为xmol/L,Fe3+完全沉淀消耗氢氧化钠为(b-a)mL,结合Fe3++3OH-═Fe(OH)3↓可知,溶液中n(Fe3+)=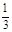 ×(b-a)×10-3Lxmol/L,
×(b-a)×10-3Lxmol/L,
Mg2+完全沉淀消耗氢氧化钠为(d-c)mL,结合Mg2++2OH-═Mg(OH)2↓可知,溶液中n(Mg2+)= ×(d-c)×10-3Lxmol/L,故原混合溶液中n(MgCl2):n(FeCl3)=
×(d-c)×10-3Lxmol/L,故原混合溶液中n(MgCl2):n(FeCl3)= ×(d-c)×10-3Lxmol/L:
×(d-c)×10-3Lxmol/L: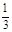 ×(b-a)×10-3Lxmol/L=3(d-c):2(b-a),故选D。
×(b-a)×10-3Lxmol/L=3(d-c):2(b-a),故选D。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《弱电解质电.. | |