1、选择题 某氯化镁溶液的密度为1.18g·cm-3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl-离子的物质的量约等于
[? ?]
A.0.37mol
B.0.63mol
C.0.74mol
D.1.5mol
参考答案:D
本题解析:
本题难度:一般
2、选择题 0.1mol?L-1BaCl2溶液100mL,和0.08mol?L-1AgNO3溶液1000mL充分混合后又加入0.06mol?L-1ZnSO41000mL,最后溶液中浓度最大的离子是( )
A.Cl-
B.Zn2+
C.Ag+
D.NO3-
参考答案:0.1mol?L-1BaCl2溶液100mL中n(Ba2+)=0.01mol,n(Cl-)=0.02mol
0.08mol?L-1AgNO3溶液1000mL中n(Ag+)=0.08mol,n(NO3-)=0.08mol,
BaCl2溶液和AgNO3溶液混合,首先发生反应:Ag++Cl-=AgCl↓,氯离子有剩余,反应后溶液中n(Cl-)=0.02mol-0.08mol=0.12mol,n(Ba2+)=0.01mol,n(NO3-)=0.08mol,
上述混合溶液再加入ZnSO4溶液,0.06mol?L-1ZnSO41000mL中n(Zn2+)=0.06mol,n(SO42-)=0.06mol,发生反应Ba2++SO42-=BaSO4↓,硫酸根有剩余,
故反应后溶液中n(SO42-)=0.06mol-0.01=0.05,n(Zn2+)=0.06mol,n(Cl-)=0.12mol,n(NO3-)=0.08mol,
故溶液中NO3-浓度最大,故选D.
本题解析:
本题难度:简单
3、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCCl4含有C-Cl键的数目为4NA
B.常温常压下,44 g由N2O与CO2组成的混合气体含有的氧原子数目为NA
C.反应NH4N3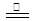 2N2↑+2H2↑,常温常压下每生成22.4LlN2,转移电子的数目为4NA
2N2↑+2H2↑,常温常压下每生成22.4LlN2,转移电子的数目为4NA
D.1 L 1 mol·L-1的AlCl3溶液中含有Cl-的数目为3NA
参考答案:D
本题解析:A中四氯化碳是液体,无法计算其物质的量,错误;B中N2O与CO2的相对分子质量相同,者是44,但含氧原子数应该在NA到2NA之间,错误;C项中不是标准状况下,无法计算其物质的量,错误;D项正确。
本题难度:简单
4、简答题 向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol/L烧碱溶液,至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672L(标准状况).据此计算:
(1)加入铝粉的质量.
(2)原硫酸铜溶液的物质的量浓度.
参考答案:发生反应的离子方程式为? 3Cu2++2Al=3Cu+2Al3+? …①Al3++4OH-=AlO2-+2H2O …②
2Al+2OH-+2H2O=2AlO2-+3H2↑…③
由题可知n(H2)=0.672L22.4L/mol=0.03mol,
则反应③消耗的n(NaOH)=0.0200mol,n(Al)=0.0200mol,
反应②消耗的n(NaOH)=2.00mol?L-1×0.210L-0.0200mol=0.400mol,
则反应①消耗的n(Al)=0.100mol,n(Cu2+)=0.150mol?
故加入铝粉的质量为 m(Al)=(0.100mol+0.0200mol)×27.0g?mol-1=3.24g,
硫酸铜溶液的浓度为c(CuSO4)=0.15mol0.03L=5mol/L,
答:(1)加入铝粉的质量为3.24g;
(2)原硫酸铜溶液的物质的量浓度为5mol/L.
本题解析:
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L苯中含有的C-H键的数目为0.6NA
B.标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA
C.14 g 由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA
D.常温下,1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA
参考答案:C
本题解析:A、标况下苯为液体,不能用气体摩尔体积计算,错误;B、氧元素有-1价到0价,生成0.2mol氧气,转移电子为0.4mol,错误;C、乙烯和环丙烷的最简式均为CH2,式量为14,故碳原子数为为NA,正确;D、该溶液中含有H+数目为0.01×1=0.01mol,错误。
本题难度:一般