1、填空题 某二元弱酸溶液按下式发生一级和二级电离:
H2A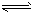 H++HA-
H++HA-
HA- H++A2-。
H++A2-。
已知相同浓度时的电离度,a(H2 A)>a(HA-),设有下列四种溶液:
A.0. 01mol/L的H2A溶液
B.0. 01mol/L的NaHA溶液
C.0. 02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0. 02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此填写下列空白(填代号):
(1)c(H+)最大的是____,最小的是____。
(2)c(H2A)最大的是____,最小的是____。
(3)c(A2-)最大的是____,最小的是____。
参考答案:(1)A ;D
(2)C ;D
(3)D ;A
本题解析:
本题难度:一般
2、选择题 25℃时,在等体积的①ph=0的 溶液、②0.05mol/L的
溶液、②0.05mol/L的 溶液、③ph=10的
溶液、③ph=10的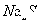 溶液、④pH=5的
溶液、④pH=5的 溶液中,发生电离的水的物质的量之比是
溶液中,发生电离的水的物质的量之比是
A.1:10:10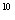 :10
:10
B.1:5:5 10
10 :5
:5 10
10
C.1:20:10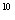 :10
:10
D.1:10:10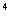 :10
:10
参考答案:A
本题解析:
正确答案:A
①中pH=0的H2SO4中c(H+)="1.0" mol·L-1,c(OH-)=1.0×10-14mol·L-1,水电离程度为1.0×10-14mol·L-1。②中c(OH-)="0.1" mol·L-1,c(H+)=1.0×10-13mol·L-1,水电离程度为1.0×10-13mol·L-1。③中c(OH-)=1.0×10-4mol·L-1,水的电离程度为1.0×10-4mol·L-1。④中c(H+)=1.0×10-5mol·L-1,水的电离程度为1.0×10-5mol·L-1。故①②③④中水的电离程度之比为:1.0×10-14mol·L-1:1.0×10-13mol·L-1:1.0×10-4mol·L-1:1.0×10-5mol·L-1=1:10:1010:109,A项正确。
本题难度:一般
3、选择题 下列说法正确的是( )
A.0.1?mol?L-l的醋酸加水稀释,c(H+)/c(OH-)减小
B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
D.VlL?pH=11的NaOH溶液与V2L?pH=3的HA溶液混合,若混合液显中性,则V1≤V2
参考答案:A.醋酸加水稀释c(H+)减小,c(OH-)增大,则c(H+)/c(OH-)减小,故A正确;
B.醋酸为弱电解质,等pH时,醋酸浓度大,反应速率大,用时少,故B错误;
C.Kw不变,只受温度的影响,故C错误;
D.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大,则V1>V2,故D错误.
故选A.
本题解析:
本题难度:一般
4、选择题 要使0.1mol/L CH3COOH溶液中CH3COOH的电离程度减小,同时又使CH3COO-浓度增大;可加入的试剂是
A.CH3COONa晶体
B.氨水
C.0.1mol/L H2SO4溶液
D.0.01mol/L CH3COOH溶液
参考答案:A
本题解析:醋酸部分电离产生CH3COO-和H+。加入CH3COONa晶体,增大了CH3COO-的浓度,使醋酸的电离平衡逆向移动,CH3COOH的电离程度减小,根据勒夏特列原理,CH3COO-的浓度增大了,故A对。加入氨水,消耗H+,H+浓度减小,平衡正向移动,CH3COOH的电离程度增大,CH3COO-浓度增大,B错。加入0.1mol/L H2SO4溶液,增大了H+浓度。平衡逆向移动,CH3COOH的电离程度减小,CH3COO-浓度也减小,C错。加入0.01mol/L CH3COOH溶液,降低了CH3COOH的浓度,CH3COOH的电离程度增大,CH3COO-浓度减小,D错。故选A
本题难度:一般
5、选择题 已知HA、H2B为二种弱酸,HA的电离常数为KHA,H2B的电离 常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不
常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不
能进行的是?(?)
A.NaA+H2B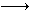 NaHB+HA? B.2NaA+H2B
NaHB+HA? B.2NaA+H2B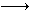 Na2B+2HA
Na2B+2HA
C.NaHB+HA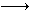 NaA+H2B? D.Na2B+HA
NaA+H2B? D.Na2B+HA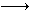 NaHB+NaA
NaHB+NaA
参考答案:BC
本题解析:略
本题难度:一般