1、选择题 下列实验不能达到预期目的的是
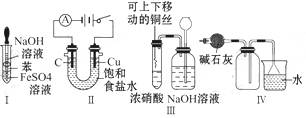
A.利用Ⅰ制取Fe(OH)2
B.利用Ⅱ装置电解饱和食盐水
C.利用Ⅲ装置进行铜与浓硝酸反应的实验
D.利用Ⅳ装置收集NH3
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列各组物质,只用水作溶剂,就能鉴别的是( )
A.CCl4、C6H14、CH3CHO三种液体
B.MnO2、CuO、FeS?三种固体
C.NH4NO3、NaOH、NaCl?三种固体
D.BaSO4、NaHCO3、CaCO3?三种固体
参考答案:A.CCl4和C6H14都不溶于水,但CCl4的密度比水大,C6H14的密度比水小,CH3CHO易溶于水,可鉴别,故A正确;
B.MnO2、CuO、FeS?三种固体都不溶于水,不能鉴别,故B错误;
C.NH4NO3溶于水吸热,NaOH溶于水放热,NaCl无明显现象,可鉴别,故C正确;
D.BaSO4、CaCO3可都不溶于水,不能鉴别,故D错误.
故选AC.
本题解析:
本题难度:简单
3、简答题 按要求填写下列实验报告:
| 实验内容 | 主要实验操作 | 主要结论
①
除去FeSO4溶液中的少量Fe2(SO4)3,
______,过滤
离子方程式为:
②
证明SO2既有漂白性又有还原性
主要现象为:
③
证明还原性:
I->Cl-
取样,______
______.
离子方程式为:
④
证明CO2具有一定的氧化性(助燃性):
化学方程式为:
参考答案:①要除去硫酸亚铁中的硫酸铁且不引进新的杂质,可以用过量铁粉,铁和铁离子反应生成亚铁离子,反应方程式为:
2Fe3++Fe=3Fe2+,故答案为:加入过量铁粉,2Fe3++Fe=3Fe2+;
②二氧化硫能使品红溶液褪色,说明二氧化硫具有漂白性,酸性高锰酸钾溶液具有强氧化性,二氧化硫能使酸性高锰酸钾溶液褪色,说明二氧化硫具有还原性,所以实验操作是:依次通入品红试液和酸性高锰酸钾溶液中,主要现象是:能使品红和酸性高锰酸钾溶液褪色,
故答案为:依次通入品红试液和酸性高锰酸钾溶液中,主要现象是:能使品红和酸性高锰酸钾溶液褪色;
③为证明碘离子还原性大于氯离子,可以用氯水和碘化物反应制取碘,再用淀粉溶液检验碘单质,碘遇淀粉变蓝色,或用萃取实验检验碘单质,氯水和碘的离子反应方程式为:2I-+Cl2=I2+2Cl-,
故答案为:滴加氯水,并用CCl4萃取(或加淀粉溶液),2I-+Cl2=I2+2Cl-;
④镁在二氧化碳气体中能剧烈燃烧生成氧化镁和碳,其操作是:将点燃的镁条插入盛有二氧化碳的集气瓶中,反应方程式为:2Mg+CO2?点燃?.?2MgO+C,该实验中体现了二氧化碳的氧化性和助燃性,
故答案为:将点燃的镁条插入盛有二氧化碳的集气瓶中,2Mg+CO2?点燃?.?2MgO+C.
本题解析:
本题难度:一般
4、选择题 下列有关实验方面的说法不正确的是
A.氯气的除杂常用饱和食盐水和浓硫酸
B.少量Na、K、Ca保存在煤油中
C.实验室制H2、Cl2、CO2的发生装置相同
D.NaOH的试剂瓶的瓶塞可用橡皮塞
参考答案:C
本题解析:略
本题难度:简单
5、实验题 某化学小组用环己醇制备环己烯

制得的环己烯粗品中含有环己醇和少量酸性杂质等。
(1)为制备环己烯精品:
①加入饱和食盐水,振荡、静置、分层,环己烯在?层(填上或下),分液后用??(填入编号)洗涤。
a.KMnO4溶液? b.稀H2SO4? c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从 ?口进入。蒸馏时要加入生石灰,目的是?。 ?口进入。蒸馏时要加入生石灰,目的是?。

③收集产品时,控制的温度应在?左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(?)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
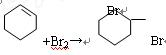
(2)在环己烯精品中滴加溴的CCl4溶液,发生反应的化学方程式?。
参考答案:(1)①上、C?②g、吸收水?③83℃、C
(2)
本题解析:略
本题难度:简单
|