1、实验题 (15分)如图,在试管a中先加入3mL95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2ml醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入 7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。

(1)用化学方程式表示反应原理___________________________??
(2)加入浓H2SO4的作用是_______________________? ??
??
(3)试管b中观察到的主要现象是_____________________________?
(4)在实验中球形干燥管除起冷凝作用外,另一个重要作用是? _____________________?。
(5)饱和Na2CO3溶液的作用是______________________________?
??。
参考答案:
(1)(3分)CH3COOH + C2H5OH CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
(2)(3分)催化剂、吸水剂
(3)(3分)上层出现无色油状液体
(4)(3分)防倒吸
(5)(3分)减少乙酸乙酯在溶液中的溶解度,除去乙酸溶解乙醇
本题解析:略
本题难度:简单
2、选择题 下列用所学知识解释或解决实验中的一些现象和问题,其中合理的是(?)
①配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出?
②硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅?
③实验室可用酒精萃取碘水中的碘?
④用加热的方法提纯含有少量碳酸氢钠的碳酸钠?
⑤可用米汤检验食用碘盐中的碘酸钾(KIO3)
⑥贮存Na2CO3时使用橡胶塞;贮存液溴、高锰酸钾时,使用玻璃塞,液溴还需水封
⑦浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
⑧NO2气体通入FeSO4溶液中无现象,说明NO2与FeSO4不反应
⑨在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
A.①②⑤⑦
B.③④⑥⑨
C.②③⑤⑧
D.②④⑥⑦
参考答案:D
本题解析:配制溶液时加水超过刻度线只能倒掉重新配制,用胶头滴管析出会导致配制的溶液浓度偏小,①错误;酒精与水互溶不能用于萃取碘水中的碘,③错误;米汤遇到碘单质变为蓝色但是遇到碘酸钾不变色,⑤错误;二氧化氮通入硫酸亚铁溶液中,二氧化氮与水反应生成了硝酸,然后再与硫酸亚铁反应,将二价铁氧化为三价铁,⑧错误;其他均正确所以答案选D。
本题难度:一般
3、选择题 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
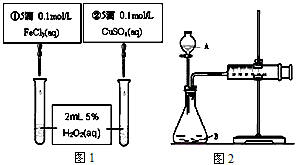
[? ]
A.图1实验可通过观察产生气泡快慢来比较反应速率的大小
B.若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置测定反应速率,只测定反应产生的气体体积即可
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
参考答案:BC
本题解析:
本题难度:一般
4、实验题 实验室需要纯净的NaCl溶液,但实验室的NaCl晶体混有少量Na2SO4和NH4HCO3,某同学按如下流程图设计实验除去杂质,回答下列问题:
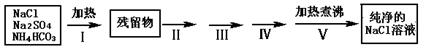
(1)步骤I除去的杂质是(填化学式)_______________,直接加热要好于加强碱后再进行加热,理由是?;
(2)按流程图完成实验设计,将相关的实验操作、实验现象和实验目的填写在下表中:
操作步骤
| 实验现象
| 实验目的
|
步骤II:将残留物溶解得到溶液,?
| ?
| ?
|
步骤III:?
?
| 
| ?
|
步骤IV:过滤,往滤液中?
?
| ?
| ?
|
步骤V:将溶液加热煮沸
| 
| ?
|
?
(3)若最后得到20℃的NaCl饱和溶液。已知20℃时NaCl的溶解度为36.0g、NaCl饱和溶液的密度为1.12g/cm3 ,则20℃的NaCl饱和溶液的物质的量浓度为?mol/L(计算结果保留三位有效数字)。
参考答案:(17分)
(1)NH4HCO3(2分)
操作简单;节省试剂;不引入新的杂质(2分,答其中两点可得满分)
(2)(共10分,除注明外每空1分,着重号为给分点)
操作步骤
实验现象
实验目的
步骤II:往溶液中滴加过量的BaCl2溶液
生成白色沉淀
除去SO42-离子
步骤III:往悬浊液中(或过滤后,往滤液中)滴加过量的Na2CO3溶液

除去过量的Ba2+离子
步骤IV:滴加适量的盐酸
产生少量气泡
除去过量的CO32-离子

?
驱赶溶解在溶液中的CO2和HCl气体(2分)
?
(3)5.07 (3分)
本题解析:(1)铵盐不稳定,受热易分解,则加热的目的是除去固体混合物中的碳酸氢铵,NH4HCO3 NH3↑+H2O↑+CO2↑;强碱与铵盐容易反应生成盐、氨气和水,除去旧杂质的同时,又引入新杂质,且增大试剂、操作步骤增多;(2)除去碳酸氢铵后,先将所得白色固体溶解,再向溶液中加入过量BaCl2溶液,使硫酸钠完全反应,生成白色的硫酸钡沉淀和NaCl,除去溶液中的硫酸根离子,但是引入的钡离子是新的杂质;为了除去钡离子,应向悬浊液或过滤所得滤液中加入过量碳酸钠溶液,使氯化钡完全与碳酸钠反应,生成白色的碳酸钡沉淀和氯化钠,除去溶液中的钡离子,但是引入的碳酸根离子是新的杂质;过滤,分离出硫酸钡、碳酸钡沉淀之后,为了除去滤液中的碳酸根离子,应向其中加入适量盐酸,碳酸钠与盐酸反应,生成氯化钠、二氧化碳气体和水,除去溶液中的碳酸根离子,但是引入的盐酸是新的杂质;盐酸和水的沸点较低,氯化钠的沸点高,将溶液煮沸,可以除去溶液中的氯化氢、二氧化碳和水,蒸发可得纯净的氯化钠固体;(3)依题意,36.0gNaCl溶于100g水中,即可配制20℃的饱和NaCl溶液;由于溶液的质量等于溶质质量与溶剂质量之和,则36.0gNaCl溶于100g水形成136.0g饱和NaCl溶液;由于溶液体积等于溶液质量与溶液密度的比值,则饱和NaCl溶液的体积为
NH3↑+H2O↑+CO2↑;强碱与铵盐容易反应生成盐、氨气和水,除去旧杂质的同时,又引入新杂质,且增大试剂、操作步骤增多;(2)除去碳酸氢铵后,先将所得白色固体溶解,再向溶液中加入过量BaCl2溶液,使硫酸钠完全反应,生成白色的硫酸钡沉淀和NaCl,除去溶液中的硫酸根离子,但是引入的钡离子是新的杂质;为了除去钡离子,应向悬浊液或过滤所得滤液中加入过量碳酸钠溶液,使氯化钡完全与碳酸钠反应,生成白色的碳酸钡沉淀和氯化钠,除去溶液中的钡离子,但是引入的碳酸根离子是新的杂质;过滤,分离出硫酸钡、碳酸钡沉淀之后,为了除去滤液中的碳酸根离子,应向其中加入适量盐酸,碳酸钠与盐酸反应,生成氯化钠、二氧化碳气体和水,除去溶液中的碳酸根离子,但是引入的盐酸是新的杂质;盐酸和水的沸点较低,氯化钠的沸点高,将溶液煮沸,可以除去溶液中的氯化氢、二氧化碳和水,蒸发可得纯净的氯化钠固体;(3)依题意,36.0gNaCl溶于100g水中,即可配制20℃的饱和NaCl溶液;由于溶液的质量等于溶质质量与溶剂质量之和,则36.0gNaCl溶于100g水形成136.0g饱和NaCl溶液;由于溶液体积等于溶液质量与溶液密度的比值,则饱和NaCl溶液的体积为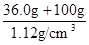 =
=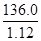 cm3=
cm3=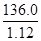 mL;溶质的物质的量等于质量与摩尔质量的比值,则136.0g饱和NaCl溶液中n(NaCl)=
mL;溶质的物质的量等于质量与摩尔质量的比值,则136.0g饱和NaCl溶液中n(NaCl)=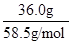 =
=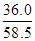 mol;由于c=n/V,则20℃的饱和NaCl溶液的物质的量浓度为
mol;由于c=n/V,则20℃的饱和NaCl溶液的物质的量浓度为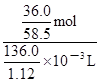 =
=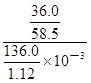 mol/L≈5.07mol/L。
mol/L≈5.07mol/L。
本题难度:一般
5、实验题 某校研究性学习小组设计实验探究元素周期律。甲、乙两同学设计了如下图所示实验。?
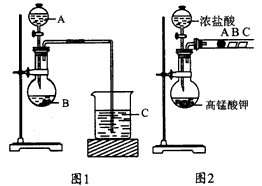
(1)甲同学设计了如图1装置,利用元素的最高价含氧酸酸性来验证同主族元素非金属性强弱的比较;甲同学设计实验的依据是___________; 写出选用物质的名称.A___________,B__________,C___________; 反应的离子方程式为____________、______________。
(2)乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学的实验原理是____________________; 写出B处的离子方程式:_________________。
参考答案:(1)强酸制弱酸 ;稀硝酸 ;碳酸钙 ;硅酸钠溶液 ;CaCO3+2H+ =Ca2+ +2CO2↑+H2O? ;
SiO32- +2CO2+ 2H2O=H2SiO3↓+2HCO3-
(2)强氧化剂生成弱氧化产物或活泼的非金属单质置换较不活泼的非金属单质 ;2I-+Cl2=2Cl-+I2
本题解析:
本题难度:一般