1、选择题 符合如下实验过程和现象的试剂组是( )
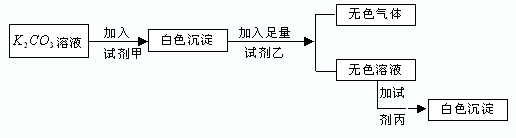
| 甲 | 乙 | 丙
A.MgCl2
HNO3
K2SO4
B.BaCl2
HNO3
K2SO4
C.NaNO3
H2SO4
Ba(NO3)2
D.BaCl2
HCl
CaCl2
|
A.A
B.B
C.C
D.D
参考答案:A.碳酸钾与氯化镁反应生成碳酸镁沉淀,加入硝酸反应生成硝酸镁溶液,加入硫酸钾不反应,故A错误;
B.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入硝酸反应生成硝酸钡溶液,加入硫酸钾生成硫酸钡沉淀,故B正确;
C.碳酸钾与硝酸钾不反应,故C错误;
D.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入盐酸反应生成氯化钡溶液,加入氯化钙不反应,故D错误.
故选B.
本题解析:
本题难度:一般
2、实验题 学习卤代烃性质时,我们知道溴乙烷在不同溶剂中与氢氧化钠发生不同类型的反应,生成不同的反应产物。我们可以通过实验的方法去验证反应的产物:
(1)在溴乙烷与氢氧化钠的乙醇溶液的__________(反应类型)中可以观察到有气体生成。某同学用如下图所示装置对该气体进行验证,他所观察到的现象是_________________________;
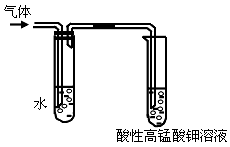
(2)盛水试管的作用是______________________;
(3)除了用酸性高锰酸钾溶液外,还可以用_________试剂检验该气体,其反应原理是_________________________(用化学方程式表示)。
(4)另一位同学取少量溴乙烷与氢氧化钠水溶液反应后的混合溶液,向其中滴加硝酸银溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与氢氧化钠水溶液反应,生成了溴化钠。老师和同学都认为这样不合理。若请你用实验验证该反应中生成了溴化钠,你与该同学实验方案不同的实验方法是___________________________________。
参考答案:(1)消去反应;高锰酸钾褪色
(2)除去气体中少量的乙醇
(3)溴水;CH2=CH2+ Br2→BrCH2CH2Br
(4)将混合溶液先用稀硝酸酸化,再向溴乙烷中加硝酸银溶液
本题解析:
本题难度:一般
3、实验题 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。 请回答该实验中的问题。

(1)写出该反应的化学方程式__________________,其中氧化剂是________,还原剂是_________。
8.4g铁粉参加反应,转移电子_________mol。
(2)玻璃管中石棉绒的作用是_______________,实验开始时应先点燃___________,实验结束时应先熄灭______________。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是__________________________;烧瓶底部应事先放置_________________,其作用是________________________。
参考答案:(1)3Fe+4H2O(g) Fe3O4+4H2;H2O;Fe;0.4
Fe3O4+4H2;H2O;Fe;0.4
(2)铁粉的载体,增大铁粉与水蒸气的接触面;酒精灯;酒精喷灯
(3)为实验提供水蒸气;碎瓷片;防止暴沸
本题解析:
本题难度:一般
4、简答题 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在.实验中从海藻提取碘的流程如图所示.
(1)指出提取碘的过程中有关的实验操作名称①______;写出过程②中有关反应的化学方程式______.
(2)提取碘的过程中可提供选择的有机试剂为______
A.酒精、四氯化碳B四氯化碳、苯C.汽油、醋酸D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是______.
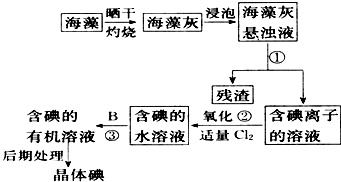
参考答案:(1)①为不溶性固体与溶液的分离,则为过滤操作,②为氯气与NaI的反应,该反应为2NaI+Cl2═2NaCl+I2,
故答案为:过滤;2NaI+Cl2═2NaCl+I2;
(2)萃取剂不能与水混溶,酒精、醋酸、甘油均不能作含碘溶液的萃取剂,故答案为:B;
(3)碘离子转化为碘的有机溶液,主要涉及灼烧、溶解过滤及分液、蒸馏等操作,过滤使用漏斗、烧杯、玻璃棒;分液需要分液漏斗等,缺少的仪器为过滤、分液漏斗,故答案为:过滤、分液漏斗.
本题解析:
本题难度:简单
5、填空题 我国规定饮用水质量标准必须符合下列要求:
pH
| 6.5~8.5
|
Ca2+、Mg2+
| <0.004 5 mol·L-1
|
细菌总数
| <100个/mL
|
以下是源水处理成自来水的工艺流程示意图
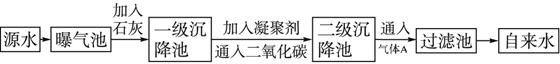
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程____________(填序号)。FeSO4·7H2O是常用的凝聚剂,它在水中最终生成____________沉淀。
①只是物理过程 ? ②只是化学过程? ③是物理和化学过程
(3)通入二氧化碳的目的是________________和______________________。
(4)气体A的作用是_________________________。这种作用是基于气体A和水反应的产物具有__________性。
(5)下列物质中____________可以作为气体A的代用品。
①Ca(ClO)2 ②NH3(液)? ③K2FeO4 ? ④SO2
参考答案:(1)Ca2++HCO-3+OH-=CaCO3↓+H2O,Mg2++2OH-=Mg(OH)2↓?
(2)③? Fe(OH)3?(3)调节pH?除去Ca2+?
(4)杀菌消毒?强氧化?(5)①③?
本题解析:(1)源水中存在Ca2+,Mg2+,HCO-3,Cl-,溶质为Ca(HCO3)2,Mg(HCO3)2,CaCl2,MgCl2,分别与Ca(OH)2发生复分解反应,化学方程式为:?Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O;?Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O;?MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2?。根据以上三个反应可以写出离子方程式:?Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓。?
(2)常用明矾、FeCl3溶液作源水的凝聚剂,利用Al3+或Fe3+水解成Al(OH)3或Fe(OH)3胶体吸附水中悬浮的固体颗粒,这一过程既有化学变化又有物理变化,如果用FeSO4·7H2O作凝聚剂,Fe2+发生水解:Fe2++2H2O Fe(OH)2+2H+,Fe(OH)2又迅速被氧化成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成Fe(OH)3沉淀。
Fe(OH)2+2H+,Fe(OH)2又迅速被氧化成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,最终生成Fe(OH)3沉淀。
(3)通入CO2的目的是调节pH和进一步除去水中的Ca2+。?
(4)通入气体A用于对源水杀菌消毒,气体A必须有强氧化性。?
(5)代替A气体的物质必须有强氧化性,可选择Ca(ClO)2,K2FeO4,O3等。
点评:本题主工考查源水处理成自来水的工艺流程,难度不大,侧重考查学生实验分析能力和逻辑推断能力,解题的关键是要结合题干信息,分析每一流程的作用,从而准确作答。
本题难度:一般