1、计算题 (8分)将锌片和银片浸入100 mL 1mol·L
参考答案:
本题解析:
本题难度:一般
2、填空题 (1)在下图的装置中,属于原电池的是____________
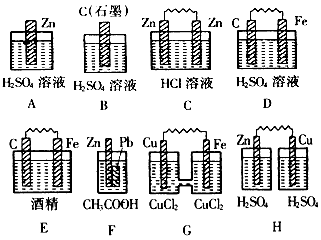
(2)以锌、石墨棒为两极,硫酸铜溶液为电解液组成的原电池的正极反应式是____________________
负极反应式是____________________。
参考答案:(1)DFG
(2)Cu2++2e-==Cu;Zn-2e-==Zn2+
本题解析:
本题难度:一般
3、选择题 一种氢氧燃料电池用30%KOH溶液为电解质溶液,有关这种电池的说法中错误的是
A.H2在负极发生氧化反应
B.供电时的总反应为:2H2 + O2 = 2H2O
C.产物为无污染的水,属于环境友好电池
D.负极反应为:H2 - 2e- = 2H+
参考答案:D
本题解析:D、H2是负极,失去电子,发生氧化反应生成H+,又电解液为30%KOH溶液,H+会和OH-反应,故负极反应式为2H2+4OH--4e-=4H2O。故错D。
点评:本题考查了氢氧燃料电池的工作原理,难度不大,写电极反应式要注意结合电解质溶液书写,如果电解质溶液不同,虽然原料相同,电极反应式也不同,如氢氧燃料电池,当电解质为酸或碱,电极反应式就不同。
本题难度:简单
4、选择题 将铝片和铜片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为( )
A.铝片、铜片
B.铜片、铝片
C.铝片、铝片
D.铜片、铜片
参考答案:铝片和铜片插入浓HNO3溶液中,金属铝会钝化,金属铜和浓硝酸之间会发生自发的氧化还原反应,此时金属铜时负极,金属铝是正极;
插入稀NaOH溶液中,金属铜和它不反应,金属铝能和氢氧化钠发生自发的氧化还原反应,此时金属铝是负极,金属铜是正极.
故选A.
本题解析:
本题难度:简单
5、填空题 (6分)航天飞机常用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-==CO32-+3H2O。
(1)负极上的电极反应为?。
(2)消耗16.8 L(标准状况下)O2时,有?mol 电子发生转移。
(3)开始放电时,正极附近溶液的氢氧根离子浓度?(填“增大”、“减小”或“不变”)。
参考答案:(1)CH4+10OH――8e―==CO32―+7H2O?(2)3?(3)增大
本题解析:略
本题难度:简单