1、选择题 在一个10L的密闭恒定温度的容器中加入1.0mol Z、1.0mol X、0mol Y开始反应,X、Y、Z三种物质物质的量随时间变化关系如右图,在5min时Z、X、Y物质的量分别是0.1mol、0.7mol、0.6mol,下列说法正确的是
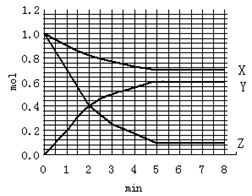
A.前5min内,Z的平均反应速率是0.9 mol/L.s
B.该反应的化学方程式可表达式:3Z + X D 2Y
C.在第2min时,Y和Z的物质的量浓度相等,表明反应处于平衡状态
D.第5min后,X、Y、Z的浓度保持不变,正反应速率等于逆反应速率
参考答案:BD
本题解析:略
本题难度:简单
2、选择题 CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。其中一种途径是将CO2转化成有机物实现碳循环。此反应达平衡时平衡常数为: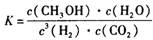 且温度升高,K值变小。下列说法正确的是
且温度升高,K值变小。下列说法正确的是
A.该反应的化学方程式为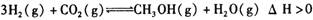
B.在恒温、恒容的密闭容器中,若混合气体的密度不再改变时,该反应一定达到平衡状态
C.平衡时,其他条件不变,使用催化剂有利用于CO2的转化
D.在恒温、恒容的密闭容器中,增大H2的浓度时,CO2的转化率增大
参考答案:D
本题解析:略
本题难度:一般
3、选择题 在一定条件下,将1mol?CO和2mol?水蒸气混合后发生如下变化:CO(g)+H2O(g)?CO2(g)+H2(g),若反应达平衡时测得CO转化率为40%,则该条件下该反应的平衡常数为( )
A.0.25
B.0.17
C.0.44
D.1.0
参考答案:平衡时测得CO转化率为40%,故参加反应的CO的物质的量为1mol×40%=0.4mol,则:
? CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):1?2? 0? 0
变化(mol):0.4? 0.4? 0.4? 0.4
平衡(mol):0.6? 1.6? 0.4? 0.4
故该温度下平衡常数k=c(CO2)?c(H2)c(CO)?c(H2O)=0.4×0.40.6×1.6=0.17,
故选B.
本题解析:
本题难度:简单
4、选择题 某温度下,反应H2(g)+I2(g) ?2HI(g),△H <0,在一带有活塞的密闭容器中达到平衡,
?2HI(g),△H <0,在一带有活塞的密闭容器中达到平衡,
下列说法不正确的是(? )
A.恒温压缩体积,平衡不移动,颜色加深
B.恒压迅速充入HI,开始时正反应速率减小
C.恒容,升温正反应速率减小
D.恒容,充入H2,I2的百分比含量降低
参考答案:C
本题解析:A正确,该反应为等体积反应,压缩体积,平衡不移动,但各组分的浓度均成倍变化;B正确,恒压充入生成物,容器体积增大,反应物的浓度减小,正反应速率开始时速率减小,而开始时逆反应速率突然增大;C错,恒容,升温正反应速率增大;D正确,恒容,充入H2,I2的转化率增大,再次平衡时百分比含量降低。
本题难度:一般
5、选择题 在恒温恒容条件下,有反应2A(g)+2B(g)  ?C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1?Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是(? )
?C(g)+3D(g),现分别从两条途径建立平衡:I.A、B的起始浓度均为2 mol·L-1?Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.下列说法正确的是(? )
A.达到平衡时,I途径的反应速率和Ⅱ途径的反应速率相同
B.达平衡时,体系内混合气体的平均密度相同
C.I、Ⅱ两途径达到平衡时,体系内混合气体的百分组成相同
D.I、Ⅱ两途径达到平衡时,体系内混合气体的平均相对分子质量不同
参考答案:C
本题解析:恒温恒容时,反应前后计量数不变的反应,若起始投料量比值相等,则两平衡等效。II中C、D的起始浓度分别为2 mol·L-1和6 mol·L-1相当于A、B的起始浓度均为4mol/L。I中A、B起始浓度均为2mol/L,达平衡时,II途径的反应速率比I途径快,A错误;达到平衡时,II中混合气体的密度是I的2倍,B错误;两途径达到平衡时是等效平衡,平衡时混合气体的百分组成相同、混合气体的平均相对分子质量相同,C正确、D错误。
点评:定温定容建立等效平衡的条件是投料量相等,对于反应前后气体化学计量数不变的反应,建立等效平衡的途径是起始投料量比值相等。
本题难度:一般