1、选择题 在一密闭容器中,CO和H2O混合加热到800℃达到下列平衡:CO(g)+H2O(g)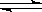 CO2(g)+H2(g) ,K=1.0,若反应开始时CO和H2O的浓度分别为0.20mol/L和1.00mol/L,则CO转化为CO2的转化率为
CO2(g)+H2(g) ,K=1.0,若反应开始时CO和H2O的浓度分别为0.20mol/L和1.00mol/L,则CO转化为CO2的转化率为
A.80%
B.83%
C.75%
D.91%
参考答案:B
本题解析:设CO转化为CO2的转化率为x,则
由反应方程式:?CO(g)+? H2O(g)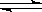 CO2(g)+H2(g) ,K=1.0
CO2(g)+H2(g) ,K=1.0
起始浓度(mol/L)0.20? 1.00? 0? 0
变化浓度(mol/L)x? x? x? x
平衡浓度(mol/L)0.20—x? 1.00—x? x? x
即:
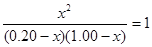 ,得
,得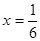 ,即得CO转化为CO2的转化率为83%
,即得CO转化为CO2的转化率为83%
本题难度:一般
2、计算题 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)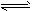 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt (N2)=13mol,nt (NH3)=6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) =________。
(4)原混合气体中,a∶b=________。
(5)达到平衡时,N2和H2的转化率之比,(N2)∶(H2)=________。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
参考答案:(1)16
(2)8mol
(3)5:4
(4)2:3
(5)1:2
(6)3:3:2
本题解析:
本题难度:一般
3、选择题 稀土是重要的战略资源,素有“工业味精”的美誉。在氧化钕(Nd2O3)等稀土催化剂的作用下可发生反应:4CO+2NO2?==N2+4CO2,若该反应的反应速率分别用v(CO)、v(NO2)、v(N2)、v(CO2)表示,则下列关系正确的是
[? ]
A. ?
?
B. ?
?
C. ?
?
D.
参考答案:A
本题解析:
本题难度:简单
4、填空题 已知以下信息:在浓硫酸中存在平衡:H2SO4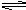 H++HSO4-? HSO4-
H++HSO4-? HSO4-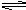 H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:
H++SO42-;PbSO4难溶于水和HNO3,但能溶于浓硫酸和醋酸铵溶液。请回答下列有关问题:
(1)在试管中加入少许PbSO4并加入数毫升水,震荡得悬浊液,往该悬浊液中加入适量醋酸铵固体,震荡后得到澄清溶液,该反应发生的原因可能是?。请写出该反应的离子方程式:?;
(2)往该澄清溶液中通入H2S气体,有黑色沉淀(PbS)生成,请写出该反应的化学方程式:?。
(3)由上面的实验推测,PbSO4和PbS的溶解度?大。
(4)将少量PbSO4粉末投入盛浓硫酸的试管,震荡后也得澄清溶液,请结合平衡移动原理解释PbSO4能溶于浓硫酸的原因?。
参考答案:
(1)(CH3COO)2Pb是难电离的物质;PbSO4+2 CH3COO - ?(CH3COO)2Pb+SO42-
?(CH3COO)2Pb+SO42-
(2)(CH3COO)2Pb+H2S=PbS↓+2CH3COOH
(3)PbSO4
(4)将PbSO4投入浓硫酸中,浓硫酸中H+结合SO42-生成HSO4-,导致平衡PbSO4(s)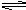 Pb2+(aq)+ SO42-(aq)向右移动,因此,PbSO4能溶于浓硫酸。
Pb2+(aq)+ SO42-(aq)向右移动,因此,PbSO4能溶于浓硫酸。
本题解析:本题主要考查学生分析问题和解决问题的能力。PbSO4的悬浊液中加入醋酸得澄清溶液,根据化合价规则,二者不发生氧化还原反应,则必发生复分解反应,故只能是生成物中有难电离的物质,只能是醋酸铅了。通入硫化氢则能得到硫化铅沉淀,即相当于在硫酸根离子、硫离子和铅离子同时存在时,硫化铅先沉淀,故硫化铅的溶解度更小。
本题难度:一般
5、选择题 为了探索外界条件对反应:aX(g)+bY(g) cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
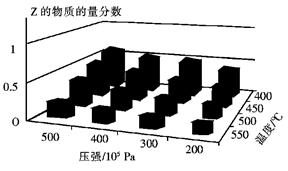
A.△H<0,a+b>c
B.△H>0,a+b<c
C.△H>0,a+b>c
D.△H<0,a+b<c
参考答案:A
本题解析:由图像右侧温度坐标轴,可知温度越高,Z的物质的量分数越小,说明升高温度平衡逆向移动,逆反应吸热,正反应放热,故△H<0;由左侧压强坐标轴,可知压强越大,Z的物质的量分数越大,说明增大压强平衡正向移动,正反应是一个气体分子总数减小的反应,故a+b>c,综合可知,应选A。
本题难度:一般