1、填空题 甲元素的原子序数是11,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为__________________________。乙单质与丙单质反应的化学方程式为______________________________________________________。
参考答案:(1)三?ⅥA?锂
(2)2Na+2H2O=2Na++2OH-+H2↑? 4Li+O2 2Li2O
2Li2O
本题解析:甲的原子序数是11,则甲是Na元素;乙有两个电子层,最外层上有6个电子,则乙是O元素;丙是第ⅠA族中金属性最弱的碱金属元素,则丙是Li元素。
本题难度:一般
2、填空题 下表为元素周期表的一部分:
?族
周期
| ?
| ?
| ?
|
1
| ①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| ?
| ?
| ②
| ?
| ?
|
3
| ③
| ?
| ?
| ④
| ?
| ⑤
| ⑥
| ?
|
?
Ⅰ.请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)写出元素②的离子结构示意图______________。
(2)②、③、⑤的离子半径由大到小的顺序为_________________________。
(3)元素④与⑥形成化合物的电子式是_________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
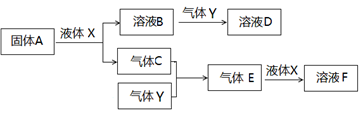
(4)写出固体A与液体X反应的离子方程式?。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为?。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,写出该条件下反应的热化学方程式?。
(7)若气体C与Y在恒容绝热的条件下反应,下列说法能判断达到平衡状态的是?。
A.温度不变? B.气体总压强不变? C.混合气体的密度不变? D.混合气体的平均分子量不变
参考答案:Ⅰ.(1)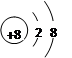 (1分)?(2)S2->O2-> Na+(2分)?(3)SiCl4
(1分)?(2)S2->O2-> Na+(2分)?(3)SiCl4
Ⅱ.(4)2Na2O2 +2H2O=4Na+ + 4OH― + O2↑(2分)
(5)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>(OH-)(2分)
(6)2SO2 +O2 2SO3?△H=—10akJ/mol(2分) (7)ABD
2SO3?△H=—10akJ/mol(2分) (7)ABD
本题解析:(1)依据元素①-⑥在表中的位置可判断,分别为H、O、Na、Si、S、Cl,其中氧离子结构示意图为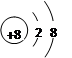 。
。
(2)核外电子层数越多微粒半径越大,在核外电子排布相同的条件下原子序数越小,微粒半径越大,则②、③、⑤的离子半径由大到小的顺序为S2->O2-> Na+。
(3)元素④与⑥形成化合物是四氯化硅,含有极性键的共价化合物,其电子式是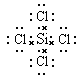 。
。
(4)A是一种淡黄色固体能与液体X反应生成气体C和来源:91考试网 91ExAm.org溶液B,则A应该是过氧化钠,X是水,C应该是氧气,B是氢氧化钠,该反应的离子方程式为2Na2O2 +2H2O=4Na+ + 4OH― + O2↑。
(5)气体Y是一种大气污染物,直接排放会形成酸雨,因此Y是二氧化硫。氢氧化钠与二元氧化铝物质的量之比为1:1且恰好完全反应时生成亚硫酸氢钠。已知亚硫酸氢钠溶液显酸性,说明溶液中HSO3-电离程度大于HSO3-水解程度,因此溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>(OH-)。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,则生成2molE即2mol三氧化硫时放出的热量是10akJ,则该条件下反应的热化学方程式为2SO2 +O2 2SO3?△H=—10akJ/mol。
2SO3?△H=—10akJ/mol。
(7)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则A、体系是绝热的,温度不变可以说明达到平衡状态,A正确;B、正方应是体积减小的可逆反应,气体总压强不变可以说明反应达到平衡状态,B正确;C、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变的,则混合气体的密度不变不能说明反应达到平衡状态,C不正确;D、混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,混合气体的平均分子量不变可以说明达到平衡状态,D正确,答案选ABD。
本题难度:一般
3、填空题 (6分)原子序数大于4的主族元素A和B的离子Am+ 和Bn-它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为______________,
② A和B的核电荷数之差为______________(用含m、n的代数式表示)
③ B和A的族序数之差为________________(用含m、n的代数式表示)
参考答案:(6分)①? 1?;②? m+n?;③? ?(每空2分)
?(每空2分)
本题解析:略
本题难度:一般
4、选择题 国际无机化学命名委员会将长式元素周期表原先的主.副族号取消,从左往右改为18列,碱金属为第1列,稀有气体为18列。按这个规定,下列说法不正确的是(?)
A.第17.18列元素都是非金属元素
B.第14列元素形成的化合物种类最多
C.第3列元素种类最多
D.只有第2列元素的原子最外层有2个电子
参考答案:D
本题解析:略
本题难度:简单
5、选择题 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是?
A.一个D2O分子所含的中子数为8
B.NH3的结构式为H—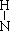 —H
—H
C.HCl的电子式为H+[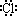 ]
]
D.热稳定性:H2S>HI
参考答案:B
本题解析:略
本题难度:一般