1、填空题 下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,
回答下列问题:
?族
周期
| IA
| ?
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ⑨
| ⑥
| ⑦
| ?
| ?
| ⑧
| ?
|
?
(1)由①、②两种元素组成的相对分子质量为28的有机物的空间构型是?,
该物质与溴水发生加成反应的化学方程式是?。
(2)用电子式表示④的简单氢化物的形成过程如下:?;
(3) 请设计实验比较元素⑥与⑨金属性的相对强弱:?_;
(4) 用①元素的单质与④元素的单质可以制成电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入①的单质,乙极通入④的单质,则甲极的电极反应式为:?。
(5)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生以下反应:
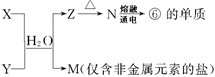
X溶液与Y溶液反应的离子方程式为?,工业上常用单质⑥冶炼难熔的金属,写出氧化铁和单质⑥在高温下反应的化学方程式?。
2、选择题 从某微粒的原子结构示意图反映出(?)
A.质子数和中子数
B.中子数和电子数
C.核电荷数和核外电子层排布的电子数
D.质量数和核外电子层排布的电子数
3、选择题 下列说法正确的是(?)
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
4、选择题 下列关于化学观或化学研究方法的叙述,错误的是 (? )
A.根据元素周期律,由HClO4可类推出氟元素也存在最高价氧化物的水化物HFO4
B.在元素周期表的金属和非金属分界线附近寻找半导体材料
C.控制实验条件可以改变可逆反应的限度和速率
D.Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
5、选择题 已知五种短周期元素的原子半径及主要化合价如下表:
元素代号
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.160
| 0.143
| 0.102
| 0.089
| 0.074
|
主要化合价
| +2
| +3
| +6、-2
| +2
| -2
|
下列叙述不正确的是( )
A.L与Q形成的化合物属于离子化合物
B.T、Q的氢化物常温常压下均为无色气体
C.L、M的单质与稀盐酸反应速率:L > M
D.M与T形成的化合物具有两性