1、填空题 (12分)t℃时,将3 mol A 和1 mol B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g) + B(g)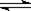 4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为_______________________。
(2)达到平衡状态时,B 物质的转化率α(B) =? _____________,
平衡常数K= _____________________(填计算结果)。
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡__________(填字母)
A、向正反应方向移动? B、向逆反应方向移动? C、平衡不移动。
(4)若向原平衡中再充入a mol C,在t℃时达到新平衡,此时B的物质的量为:
n(B) =? ___________________ mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间该满足的关系为:
____________________________________。
参考答案:(1)0.2mol/(L·min-1),(2)20% ,1/27=0.037?(3)C
(4)(0.8+0.2a)?(5)n(A)=3n(B),n(C)>0
本题解析:(1) 2min时C的浓度为0.4 mol/L,所以生成C的平均反应速率为0.2mol/(L·min-1)。

(3)通入少量氦气后,体积不变,故A、B、C的浓度不变,因此平衡不移动。
(4)再充入a mol C,相对于又充入了3/4amolA和1/4amolB,因为反应前后体积,而此时A和B的物质的量的之比仍然满足3︰1,故平衡与最初的平衡等效,因此B的转化率还是20%,故达到新平衡,B的物质的量为(1+0.25a)mol×80%=(0.8+0.2a)mol。
(5)根据(4)的分析可知只要A和B的物质的量之比满足3︰1即可。
本题难度:一般
2、选择题 在已处于化学平衡状态的体系中,如果下列量发生变化,一定能表明平衡移动的是(? )
A.反应混和物的浓度
B.反应物的转化率
C.正、逆反应速率
D.反应混和物的压强
参考答案:B
本题解析:A 错 如果反应前后气体体积相等,增大压强,气体浓度增大,平衡不移动
B 对 反应物的转化率改变,平衡一定改变
C.错 如果使用催化剂,正、逆反应速率都增大,但平衡不移动
D 错,如果在一平衡体系中,加入稀有气体,压强增大,但平衡不改变。
本题难度:一般
3、填空题 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:
2SO2(g)+O2(g) 2SO3(g)(正反应放热)
2SO3(g)(正反应放热)
反应过程中SO2、O2、SO3物质的量变化如图2-61所示:

图2-61
完成下列问题:
(1)降低温度,SO2的转化率____________,化学反应速度____________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是____________。
(3)反应进行至20 min时,曲线发生变化的原因是________________________ (用文字表达)。10 min到15 min的曲线变化的原因可能是____________(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
参考答案:(1)增大减小(2)15~20 min,25~30 min(3)增加了O2的量? ab
本题解析:(1)降温,平衡向正反应方向移动,SO2的转化率增大,化学反应速率降低。
(2)反应进行15 min时,SO2、O2、SO3的物质的量均不发生变化,说明反应达到了平衡状态。
(3)反应进行至20 min,O2的物质的量发生突变,说明此时增加了O2的量。
本题难度:一般
4、计算题 将相同物质的量的SO3充入下面的两个容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应:2SO3(g) ?2SO2(g)+O2(g),在反应过程中维持体系温度不变。
?2SO2(g)+O2(g),在反应过程中维持体系温度不变。
(1)求达到平衡状态时SO3气体的转化率的大小关系?
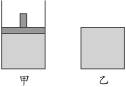 图2-2
图2-2
(2)达到平衡状态时分别充入一定量的Ar气,平衡是否会移动?会怎样移动?
参考答案:(1)甲容器中SO3的转化率比乙容器中SO3的转化率要大
(2)甲容器平衡向正反应方向移动,SO3的转化率增大,乙容器平衡不移动
本题解析:开始时两个容器中SO3的物质的量、体积、温度都是相等的,而且在反应过程中维持温度不变,即两个容器的温度始终是相同的,由于反应是一个气体分子数目增多的反应,所以对于乙容器来说,随着反应的不断进行其压强会逐渐增大,而甲容器随着气体分子数目的增多,活塞会逐渐向上移动,其体积会逐渐增大,所以乙容器相当于在A容器的基础上进行加压,而对于可逆反应2SO3(g) ?2SO2(g)+O2(g),加压会使得平衡向逆反应方向移动,这样会使转化率减小,所以达到平衡状态时甲容器中SO3的转化率比乙容器中SO3的转化率要大。
?2SO2(g)+O2(g),加压会使得平衡向逆反应方向移动,这样会使转化率减小,所以达到平衡状态时甲容器中SO3的转化率比乙容器中SO3的转化率要大。
当两个容器中都达到平衡状态后,再分别充入一定量的Ar气,乙容器由于体积没有改变,反应体系中各种物质的浓度并没有变化,正、逆反应速率仍然相等,所以其平衡不会移动。甲容器由于活塞的移动会导致体积增大,三种物质的浓度同等倍数减小,这和直接将活塞向上提一样,所以这时的情况相当于压强减小,其平衡向正反应(气体分子数目增多)方向移动,SO3的转化率要增大。
本题难度:简单
5、选择题 一定温度下,某密闭容器中存在可逆反应:X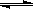 Y+Z,其化学反应速率随时间变化的图像如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是(? )
Y+Z,其化学反应速率随时间变化的图像如图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法不正确的是(? )

A.X在该条件下一定不为气体
B.Y和Z在该条件下至少有一种为气体
C.t1时刻达到平衡时和t3时刻平衡时,气态物质的浓度相同
D.由t1~t3,平衡并未发生移动。
参考答案:D
本题解析:根据图像可知,增大压强,正反应速率不变,逆反应速率增大这说明反应物中没有气体,生成物中含有气体。由于两次的平衡中反应速率是相同的,所以气态物质的浓度相同。根据图像可知,平衡向逆反应方向移动,所以选项D是错误的,其余都正确。答案选D。
本题难度:一般