1、填空题 (共6分,每空2分).从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________________________;
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是________________________________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_________________________________。
参考答案:(1)HCl,CuCl2(2)Na2SO4,H2SO4(3)NaCl,CuSO4
本题解析:略
本题难度:简单
2、选择题 如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是
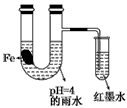
[? ]
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水液面回升时,正极反应式为:O2+2H2O+4e-==4OH-
D.U型管中溶液pH逐渐减小
参考答案:C
本题解析:
本题难度:一般
3、填空题 ( 9分)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含乙酸钠和对氯酚( )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。
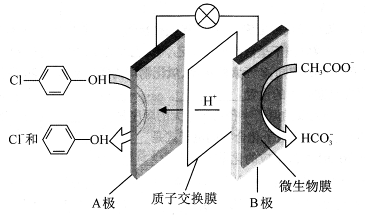
①B是电池的 极(填“正”或“负”);②A极的电极反应式为 。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA ”表示乳酸分子,A-表示乳酸根离子)。
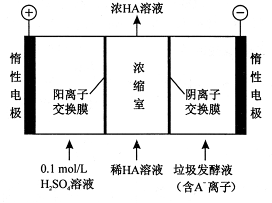
①阳极的电极反应式为 ;
②简述浓缩室中得到浓乳酸的原理 ;
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8 ,此时进人浓缩室的OH-可忽略不计。400 mL10g/L 乳酸溶液通电一段时间后,浓度上升为 145g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为 L(乳酸的摩尔质量为90g/ mol )。
参考答案:(1)①负;② +H++2e-=
+H++2e-=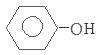 +Cl-;
+Cl-;
(2)①4OH--4e-=2H2O+O2↑;②阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;A-通过阴离子交换膜从阴极进入浓缩室,H++A-=HA,乳酸浓度增大;③6.72
本题解析:(1)①由于H+向A极板移动,根据同种电荷相互排斥,异种电荷相互吸引的原则,所以B是电池的负极;②A极的电极反应式为 +H++2e-=
+H++2e-= +Cl-;(2) ①在阳极溶液中的阴离子放电,由于OH-的放电能力大于含氧酸根离子,所以在阳极OH-放电,该电极的电极反应式为4OH--4e-=2H2O+O2↑;在阳极发生反应:2H++2e-=H2↑;②浓缩室中得到浓乳酸的原理是在阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;A-通过阴离子交换膜从阴极进入浓缩室,H++A-=HA,所以乳酸浓度增大;③反应过程中产生的乳酸的质量是0.400 L(145g/L -10g/L)=54g.则乳酸的物质的量是54g÷90g/ mol=0.6mol;因为在反应过程乳酸根离子结合的H+离子的个数与反应过程中放电的H+或OH-的个数相等,所以n(H2)=1/2n(乳酸)=0.3mol,其在标准状况下体积是0.3mol×22.4L/mol=6.72L。
+Cl-;(2) ①在阳极溶液中的阴离子放电,由于OH-的放电能力大于含氧酸根离子,所以在阳极OH-放电,该电极的电极反应式为4OH--4e-=2H2O+O2↑;在阳极发生反应:2H++2e-=H2↑;②浓缩室中得到浓乳酸的原理是在阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;A-通过阴离子交换膜从阴极进入浓缩室,H++A-=HA,所以乳酸浓度增大;③反应过程中产生的乳酸的质量是0.400 L(145g/L -10g/L)=54g.则乳酸的物质的量是54g÷90g/ mol=0.6mol;因为在反应过程乳酸根离子结合的H+离子的个数与反应过程中放电的H+或OH-的个数相等,所以n(H2)=1/2n(乳酸)=0.3mol,其在标准状况下体积是0.3mol×22.4L/mol=6.72L。
考点:考查电池电极的判断、电解原理的在废水处理中的应用和计算的知识。
本题难度:困难
4、填空题 (15分)认真观察下列装置,回答下列问题:
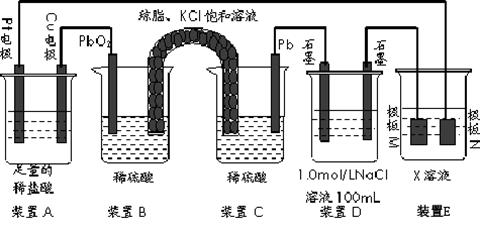
(1)装置B中PbO2上发生的电极反应方程式为 。
(2)装置A中总反应的离子方程式为 。
(3)若装置E中的目的是在Cu材料上镀银,则极板N的材料为 。
若装置E的目的是验证金属的电化学防腐,则极板N的材料为__________________ 。
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为 L(标准状况下)。
参考答案:19.(1)PbO2+4H++SO42-+2e-=PbSO4+2H2O (2)Cu+2H+ Cu2++H2↑
Cu2++H2↑
(3)Ag 惰性电极(或石墨等不溶性惰性材料) (4)3.92
本题解析:(1)根据装置图可知,BC是原电池,二氧化铅是正极,得到电子,电极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O
(2)A中铜电极和正极相连,是阳极,铜失去电子。阴极是Pt,溶液中的氢离子得到电子,所以总的反应式为Cu+2H+ Cu2++H2↑
Cu2++H2↑
(3)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,所以X是硝酸银溶液,N是阳极,则N是银。由于N是阳极,所以若装置E的目的是验证金属的电化学防腐,则极板N的材料应为惰性电极。
(4)当装置A中Cu电极质量改变6 .4g时,转移电子是6.4g÷64g/mol×2=0.2mol。装置D中氯化钠是0.1mol,阴极是氢离子放电,氢气是0.1mol。阳极是氯离子放电,生成氯气,物质的量是0.05mol ,所以阴极还生成氧气,物质的量是0.1mol÷4=0.025mol,所以标准状况下的体积共计是(0.1mol+0.05mol+0.025mol)×22.4L/mol=3.92L.。
考点:考查铅蓄电池,电解。
本题难度:一般
5、简答题 某校开展课外研究性学习活动.
I、第一小组对市场上的碘盐进行了研究.在碘盐里,碘以KIO3形式存在.请回答下列问题:
(1)正确食用碘盐才能起到补碘的作用,该小组对油炸食品时是否适宜放碘进行了课题研究.
请你协助拟定课题名称:______.
其研究成果的最终形式是:______.
(2)怎样检验碘盐中含有碘?(可供选择的试剂有:稀硝酸、稀盐酸、KCl、KI淀粉溶液、石蕊试液)用离子方程式表示______.
Ⅱ、第二小组利用废铜制取CuSO4:
(1)甲学生进行了下列实验:取含6.4g铜的废铜和10mL?18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余.他根据自己所学的化学知识,认为烧瓶中还有较多的硫酸剩余.你认为他的判断是否正确______(填是或否),其理由是______.
(2)乙同学认为甲设计的方案不好,他自己设计的思路是:2Cu+O2?
?2CuO、CuO+H2SO4=CuSO4+H2O.
对比甲的方案,乙同学的优点是:______.
(3)某地有丰富的电力源,为了同时具备乙同学的优点,你能不能根据该地的资源优势也设计一个用铜和硫酸制取CuSO4的方案?(其他材料任选)______.
参考答案:I、(1)联想炸油条的方法,温度是关键,所以课题名称应包含温度因素,研究成果的战士展示方法是多样的,如研究报告(或实验报告或论文),
故答案为:温度对KIO3稳定性的影响(或油炸食品时是否适宜放碘盐等其他合理答案);研究成果的最终形式:研究报告(或实验报告或论文等);
(2)碘酸根离子具有氧化性,碘离子具有还原性,在酸性环境下会发生氧化还原反应,实质为:IO3-+5I-+6H+=3I2+3H2O,故答案为:IO3-+5I-+6H+=3I2+3H2O;
Ⅱ、(1)在Cu和浓硫酸的反应中,随反应的进行硫酸的浓度减小,而稀硫酸不与铜反应,所以烧瓶中还有较多的硫酸剩余,故答案为:是;随反应的进行硫酸的浓度减小,而稀硫酸不与铜反应;
(2)对比两种设计方案:甲::Cu+2H2SO4(浓) ?△?.? SO2↑+CuSO4+2H2O,
乙:2Cu+O2?△?.? 2CuO、CuO+H2SO4=CuSO4+H2O,可以看出制取等量的硫酸铜,乙方案消耗的硫酸少,并且产物中没有有毒气体,故答案为:硫酸的用量少,且没有污染物SO2产生;
(3)用铜和硫酸制取CuSO4的反应是一个非自发的氧化还原反应,根据提示“电力资源”丰富,结合电解原理,可得电解法方案,即可以用废铜作阳极,碳棒作阴极,稀硫酸作电解质溶液进行电解,
故答案为:用废铜作阳极,碳棒作阴极,稀硫酸作电解质溶液进行电解.
本题解析:
本题难度:一般