1、选择题 氯分子式为(CN)2,结构可表示为N≡C-C≡N,性质与卤素相似,下列叙述中正确的是( )
A.NaCN与AgCN都易溶于水
B.(CN)2能与NaOH溶液反应
C.若四个原子在一条直线上,则为极性分子
D.C≡N的键长大于C-C键
参考答案:A.卤化银都难溶于水,故AgCN难溶于水,故A错误;
B.性质与卤素相似,(CN)2能与NaOH溶液反应,(CN)2 +2NaOH═NaCN+NaCNO+H2O,故B正确;
C.若四个原子在一条直线上,结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子,故C错误;
D.C-C 键长0.154nm,C≡N键长0.152nm,C≡N的键长小于C-C键,故D错误.
故选B.
本题解析:
本题难度:一般
2、实验题 (14分) 如图所示是一个制取Cl2并以Cl2为原料进行特定反应的装置,其中各试剂瓶所装试剂为:B(Na2S)、C(FeBr2)、D(淀粉-KI)、E(SO2和BaCl2)、F(水)、H(紫色石蕊)
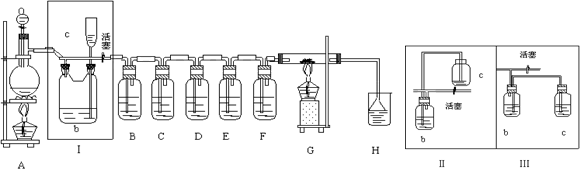
(1)写出实验室制取Cl2的化学方程式___________________________________________________________
(2)Ⅰ中b瓶内加入的液体是?。装置Ⅰ还可用右图中的装置_______(Ⅱ或Ⅲ)代替
(3)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让Cl2充满整个装置,再点燃G处酒精灯,回答下列问题:
①下列装置中的现象是B? _________________;D?_______________________?__
②写出E中反应的离子方程式:
_____________________________________;________________________________________
(4)G中硬质玻璃管内盛有碳粉,反应后的产物为CO2和HCl,写出G中的反应的化学方程式__________
(5)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__________________________
参考答案:(14分) (1)MnO2+4HCl(浓) MnCl2+H2O+Cl2↑?(2)饱和食盐水? Ⅱ
MnCl2+H2O+Cl2↑?(2)饱和食盐水? Ⅱ
(3)①有浅黄色沉淀生成;溶液变蓝?
②Cl2+SO2+2H2O=4H++SO42-+2Cl-? Ba2++SO42-=BaSO4↓
(4) C+2H2O+2Cl2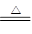 CO2↑+4HCl↑
CO2↑+4HCl↑
(5)Cl2与H2O反应生成的HCl使紫色石蕊试液变红色,剩余的Cl2又与水作用生成HClO,又起漂白作用,使红色褪去
本题解析:(1)实验室制取氯气的方程式是MnO2+4HCl(浓) MnCl2+H2O+Cl2↑。
MnCl2+H2O+Cl2↑。
(2)由于浓盐酸具有挥发性,所以生成的氯气中含有氯化氢气体,所以b瓶内加入的液体是饱和食盐水,目的是除去氯气中的氯化氢气体。装置Ⅰ的作用是起安全瓶的作用,所以还可用右图中的装置应该是Ⅱ。
(3)①氯气具有强氧化性,能氧化硫化钠生成单质S,所以B中有浅黄色沉淀生成;氯气能把碘化钾氧化生成单质碘,而碘遇淀粉显蓝色。
②由于氯气能把SO2氧化生成硫酸,进而生成硫酸钡白色沉淀,所以E中反应的离子方程式是Cl2+SO2+2H2O=4H++SO42-+2Cl-、Ba2++SO42-=BaSO4↓。
(4)根据生成物可知,有水参加,所以反应的方程式是C+2H2O+2Cl2 CO2↑+4HCl↑。
CO2↑+4HCl↑。
(5)由于Cl2与H2O反应生成的HCl使紫色石蕊试液变红色,剩余的Cl2又与水作用生成HClO,又起漂白作用,所以使红色褪去。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求考生必须冷静的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能正确作答。
本题难度:一般
3、选择题 下列实验过程中,始终无明显现象的是( )
A.Cl2通入AgNO3溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入Ba(NO3)2溶液中
参考答案:A.氯气与水反应生成盐酸和次氯酸,盐酸与硝酸银反应生成氯化银白色沉淀,故A不选;
B.因碳酸酸性比盐酸弱,CO2与CaCl2溶液不反应,无任何现象,故B选;
C.氨气溶液呈碱性,生成白色氢氧化铝沉淀,故C不选;
D.二氧化硫溶液呈酸性,酸性条件下,可被硝酸根离子氧化生成硫酸根离子,可生成硫酸钡沉淀,故D不选.
故选B.
本题解析:
本题难度:简单
4、选择题 下列家庭化学小实验不能达到预期目的的是(?)
A.用米汤检验食用加碘盐(含KIO3)中含有碘
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用碘酒检验汽油中是否含有不饱和烃
D.用醋和小苏打制取二氧化碳
参考答案:A
本题解析:略
本题难度:一般
5、填空题 工业合成氨与制备硝酸一般可连续生产,流程如下:
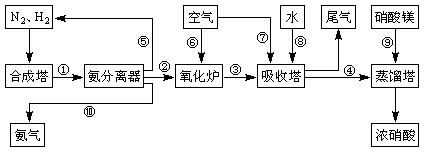
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=________。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
T/K
| T1
| 573
| T2
|
K
| 1.00×107
| 2.45×105
| 1.88×103
|
T1____573K(填“>”、“<”或“=”)。
 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
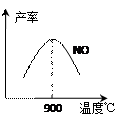
不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因?。
(4)吸收塔中发生反应的化学方程式为:
?。
(5)上述工业流程中,采用了循环操作工艺的是?(填序号)
(6)硝酸厂的尾气含有氮氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);?△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);?△H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_____________________________。
参考答案:
(1)① 1(2分);?② 50%(2分);?(2)< (1分)
(3)温度高于900℃时,平衡向左移动。(1分)
(4)2NO+O2=2NO2,3NO2+H2O=2HNO3+NO(2分。1个方程式1分)
(5)⑤(1分)
(6)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)?△H=-867kJ/mol(2分)
本题解析:略
本题难度:一般