1、实验题 (6分)某化学兴趣小组用铁矿石(主要成分为Fe203,还有Si02、A1203
等杂质)提取Fe2O3。操作讨程如下:

(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是?;
(2)沉淀A中主要含有?,固体B是?;
(3)滤液Y中的阴离子除OH-、Cl-外,还有?;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式?
参考答案:(1) 过滤? (2)SiO2或二氧化硅? Fe203或氧化铁 (3 [Al(OH)4]-或A102-? (4)Fe3++3OH-==Fe(OH)3↓
本题解析:(1)过滤适用于不溶性固体和液体之间的一种分离方法,所以分离溶液和沉淀的操作名称是过滤。
(2)氢氧化铁受热分解生成氧化铁,所以B是氧化铁。
(3)二氧化硅和盐酸不反应,氧化铁、氧化铝和反应,所以沉淀A是二氧化硅。X中含有氯化铁、氯化铝和过量的盐酸。由于氢氧化铝能溶于氢氧化钠溶液中,所以滤液Y中还含有偏铝酸钠。
(4)氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,反应的离子方程式是Fe3++3OH-==Fe(OH)3↓
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则:
1. 不能引入新的杂质(水除外)。即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中。
2. 分离提纯后的物质状态不变。
3. 实验过程和操作方法简单易行。即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:
1. 分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解) ,溶解,过滤(洗涤沉淀) ,蒸发,结晶(重结晶) ,电精炼。
2. 分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏。
3. 分离提纯物是胶体:盐析或渗析。
4. 分离提纯物是气体:洗气。
本题难度:一般
2、选择题 把含有氧化铁的铁丝投入足量的稀硫酸中,直到固体全部溶解。经分析,溶液中无Fe3+,且生成的Fe2+与反应产生的H2的物质的量之比为4:1。则原混合物中氧化铁与铁的物质的量之比为
A.1:2
B.2:5
C.3:2
D.4:1
参考答案:A
本题解析:设原混合物中含有xmolFe,ymolFe2O3,
Fe2O3+6HCl=2FeCl3+3H2O
y? 2y?
2FeCl3+Fe=3FeCl2
2y? y? 3y
Fe + 2HCl = FeCl2 + H2↑
(x-y)?(x-y)(x-y)
则:[3y+(x-y)]:(x-y)=4:1,
y:x=1:2,
本题难度:一般
3、计算题 在500g稀硝酸中投入48g铁粉,若两种物质恰好完全反应(还原产物为NO)。求:
(1)稀HNO3的质量分数?
(2)被还原的硝酸的物质的量?
参考答案:(1)若铁不过量,则生成物为Fe(NO3)3
设HNO3的质量为x
Fe? +? 4HNO3====Fe(NO3)3+NO↑+2H2O
56g?252g
48g?x
x=(252g×48g)/56g=216g
HNO3的质量分数=216g/500g×100%=43.2%


(2)若铁过量,Fe(NO3)3全部被还原,则生成物为Fe(NO3)2。
设HNO3的质量为y
3Fe? +? 8HNO3====3Fe(NO3)2+2NO↑+4H2O
168g?504g
48g?y
y=(504q×48g)/168g=144g
HNO3的质量分数=144g/500g×100=28.8%
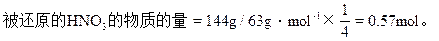
因此硝酸的质量分数为28.8%≤HNO3%≤43.2%
被还原的硝酸的物质的量为0.57mol≤被还原的HNO3的物质的量≤0.857mol。
本题解析:本题考查了学生的审题能力。本题看上去简单,实际上很复杂。这是因为硝酸与铁反应时,两者相对量的不同,最终生成物也不一样。若铁与硝酸适量完全反应,则生成Fe(NO3)3;若铁过量,则生成的Fe(NO3)3要与铁反应,而最终生成Fe(NO3)2,第一种情况,消耗硝酸较多,第二种情况消耗的硝酸的量较少(因为铁的质量一定)。若消耗的硝酸的量介于两者之间,即过量不多,则生成和中既有Fe(NO3)2,又有Fe(NO3)3。因此,本题计算的结果不是确定值,而是在一定的范围内,故可分两种情况讨论。
本题难度:一般
4、填空题 (6分)将一定质量的铁投入20 mL浓硫酸中,加热充分反应后固体有剩余并收集气体4.48 L(标准状况),质量为6.6 g;则
(1)参加反应的铁的质量为 ?.
(2)硫酸溶液的物质 的量浓度为 ?.
的量浓度为 ?.
参考答案:(1)11.2 g (2)15 mol/L
本题解析:略
本题难度:简单
5、简答题 查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
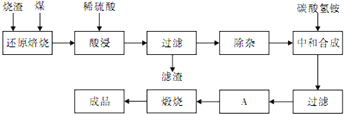
(1)焙烧时产生的主要有害气体是______.
(2)为测定过滤所得滤液中Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,写出该反应的离子方程式:______;实验中所用酸性高锰酸钾溶液浓度为0.10mol/L,滤液用______滴定管量取20.00ml,用酸性高锰酸钾溶液滴定到终点时消耗了标准的酸性高锰酸钾溶液12.04ml,滤液中c(Fe2+)=______.
(3)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:______(用离子方程式表示).
(4)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2
开始沉淀的pH
3.10
2.01
7.11
万全沉淀的pH
4.77
3.68
9.61
|
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于______,检验Fe3+已经除尽的试剂是______(除KSCN外).
(5)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是______.
参考答案:(1)硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),依据流程分析,加入碳还原会和二氧化硅反应生成硅和一氧化碳,硫铁矿燃烧会生成二氧化硫,生成的污染性气体为一氧化碳和二氧化硫,
故答案为:CO、SO2;
(2)依据高锰酸钾溶液氧化亚铁离子为铁离子,本身被还原为锰离子,依据电荷 守恒,电子守恒,原子守恒配平书写离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,滤液呈酸性需要用酸性滴定管取用,依据离子方程式计算得到滤液中亚铁离子物质的量,
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
1 5
0.10mol/L×0.012.04l n(Fe2+)
n(Fe2+)=0.00602mol
得到亚铁离子的浓度为0.00602mol0.02L=0.0301mol/L,
故答案为:酸式,0.0301mol/L;
(3)在空气中“酸浸”时间过长,溶液中Fe2+含量将下降的原因是亚铁离子在酸性溶液中被氧气氧化为铁离子,反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;
(4)除去Fe3+和Al3+,依据图表中沉淀所需PH分析,溶液PH小于7.11时,亚铁离子不沉淀,铁离子和铝离子完全沉淀,检验铁离子除KSCN外,可以加入苯酚出现紫色证明铁离子的存在,
故答案为:7.11,苯酚;
(5)将溶液中Fe2+转变为碳酸亚铁沉淀,防止混入杂质,需要对沉淀继续洗涤干燥,
故答案为:洗涤或洗涤、干燥;
本题解析:
本题难度:一般