1、实验题 (6分)某化学兴趣小组用铁矿石(主要成分为Fe203,还有Si02、A1203
等杂质)提取Fe2O3。操作讨程如下:

(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是?;
(2)沉淀A中主要含有?,固体B是?;
(3)滤液Y中的阴离子除OH-、Cl-外,还有?;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式?
2、选择题 把含有氧化铁的铁丝投入足量的稀硫酸中,直到固体全部溶解。经分析,溶液中无Fe3+,且生成的Fe2+与反应产生的H2的物质的量之比为4:1。则原混合物中氧化铁与铁的物质的量之比为
A.1:2
B.2:5
C.3:2
D.4:1
3、计算题 在500g稀硝酸中投入48g铁粉,若两种物质恰好完全反应(还原产物为NO)。求:
(1)稀HNO3的质量分数?
(2)被还原的硝酸的物质的量?
4、填空题 (6分)将一定质量的铁投入20 mL浓硫酸中,加热充分反应后固体有剩余并收集气体4.48 L(标准状况),质量为6.6 g;则
(1)参加反应的铁的质量为 ?.
(2)硫酸溶液的物质 的量浓度为 ?.
的量浓度为 ?.
5、简答题 查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
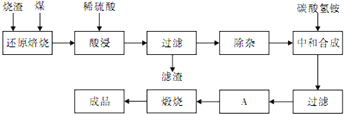
(1)焙烧时产生的主要有害气体是______.
(2)为测定过滤所得滤液中Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,写出该反应的离子方程式:______;实验中所用酸性高锰酸钾溶液浓度为0.10mol/L,滤液用______滴定管量取20.00ml,用酸性高锰酸钾溶液滴定到终点时消耗了标准的酸性高锰酸钾溶液12.04ml,滤液中c(Fe2+)=______.
(3)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:______(用离子方程式表示).
(4)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2
开始沉淀的pH
3.10
2.01
7.11
万全沉淀的pH
4.77
3.68
9.61
|
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于______,检验Fe3+已经除尽的试剂是______(除KSCN外).
(5)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是______.