1、计算题 为测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓HNO3中,将合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的pH=0,假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的HNO3的物质的量。
(2)合金中Ag的质量分数。
参考答案:
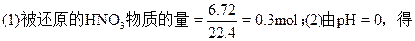
[H+]=1mol/L。
所以,参加反应的HNO3总物质的量=(13.5-1)×0.08=1mol。
设:合金含Agxg,含Cu(30-x)g则
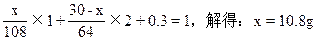
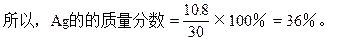
本题解析:本题解题关键在于把握Cu,Ag与浓HNO3反应过程中,隐含了浓HNO3稀释的计算实质,即所涉及的反应有四个:
Ag+2HNO3(浓)====AgNO3+NO2↑+H2O? (1)
Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O? (2)
3Ag+HNO3(稀)====3AgNO3+NO↑+2H2O? (3)
3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O? (4)
采取对反应体系的始态与终态进行整体分析,利用守恒法则可获得十分简捷的计算。
观察四个化学方程式,不难看出:被还原的HNO3均转化成NO和NO2,根据N原子数守恒分析,被还原的硝酸的物质的量等于NO与NO2物质的量之和。从已知的NO与NO2的总体积进而可求得被还原的HNO3的量。
从HNO3的作用分析:消耗HNO3的总物质的量等于被还原HNO3与只起酸性作用的HNO3物质的量之和。由化学式AgNO3和Cu(NO3)2,可将只做酸用的HNO3量以Ag和Cu的物质的量代换,即:
n(HNO3)====n(NO+NO2)+n(Ag)+2n(Cu)
据此可简捷地求得Ag的质量分数。
本题难度:一般
2、选择题 将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
A.5.52g
B.(m+6.8)g
C.(m+2.55)g
D.(m+12.0)g
参考答案:C
本题解析:所得还原产物为0.05mol NO,所以转移的电子数就是0.15mol,铁粉与铜粉共失去0.15mol电子,带0.15mol的正电荷,所以要结合0.15mol氢氧根离子,沉淀质量为铁粉与铜粉的质量mg+0.15mol氢氧根离子,即为(m+2.55)g,故选C。
本题难度:简单
3、选择题 久置于空气中的下列物质,因被氧化而呈黄色的是
A.浓硝酸
B.氯化亚铁溶液
C.溴苯
D.溴化银
参考答案:B
本题解析:硝酸不稳定,在空气中分解(被还原成NO2)生成NO2,生成的NO2溶于其中显黄色;Fe2+不稳定,在空气中被氧气氧化成Fe3+而显黄色,苯酚在空气中不稳定,氧化后显粉红色,而溴苯无此现象;溴化银不稳定,分解后显黑色,其原因是溴化银被还原生成了银粉末。
本题难度:简单
4、填空题 (14分).以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7 H2O。
H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量酸,该酸最好是?。运用化学平衡原理简述该酸的作用________________________________________________________________________。
(3)Ⅲ中,生成FeCO3的离子方程式是___________________________________________
若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_______________________________________。
(4)Ⅳ中,通过检验SO来判断沉淀是否洗涤干净,检验SO的操作是__________
________________________________________________________________________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O22Fe2O3+4CO2。现煅烧464.0  kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
参考答案:

本题解析:略
本题难度:一般
5、填空题 铜是一种与人类关系非常密切的有色金属。常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu+=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu20、Cul、CuCl、CuH 等。
(1)在CuCl2溶液中逐滴加入过量KI溶液,可能发生的反应有:
2Cu2++4I-=2CuI↓(白色)+I2; 2Cu2++4I-+2Cl-=CuCl↓(白色)+I2
已知:常温下Ksp(CuCl)=1.20×10-6(mol/L)2; Ksp(CuI)=5.06×10-12(mol/L)2。由此推断上述反应生成主要沉淀物的化学式是______。
(2)向CuH中加入过量稀HC1,有气体生成,该反应的离子方程式为______。
(3)将冰铜(由Cu2S和FeS熔合成含Cu 18%—20%的一种物质)加入熔剂,在髙温下吹入空气,冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应生成粗铜。上述两个反应的化学方程式分别是______、______。
(4)常温下,向0.20 mol ? L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=______mol.L?1。[已知:Ksp(CuI)=2.2×10-20(mol/L)3]
(5)将0.80 gCuSO4 ? 5H2O样品加热分解,其脱水过程中固体质量随温度的变化如下图所示。

请确定110°C时固体物质的化学式____________。(要求写出推断过程)
参考答案:(14分)
(1)CuI(2分)
(2)2CuH+2H+= Cu2++ Cu+2H2↑(2分)
(3)2Cu2S+3O2 2Cu2O+2SO2(2分);2Cu2O+Cu2S
2Cu2O+2SO2(2分);2Cu2O+Cu2S 6Cu+SO2↑(2分)
6Cu+SO2↑(2分)
(4)2.2×10-4?(2分)
(5)设110℃时固体物质的化学式为CuSO4·xH2O,依据题意得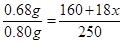 ,解得x=3,该固体物质的化学式为CuSO4·3H2O。(关系式2分,结果2分,共4分,其它合理解法不扣分)
,解得x=3,该固体物质的化学式为CuSO4·3H2O。(关系式2分,结果2分,共4分,其它合理解法不扣分)
本题解析:(1)由于CuI的Ksp较小,且加入过量KI溶液,假设生成CuCl也会转化为CuI,所以最终生成CuI
(2)Cu+在酸性条件下易发生歧化反应:2Cu+=Cu2++Cu;所以发生反应2CuH+2H+= Cu2++ Cu+2H2↑
(3)根据信息提示,注意硫元素燃烧后生成SO2,根据质量守恒定律,写出方程。见答案
(4)由pH = 6知C(OH-)=10-8mol/L,代入Ksp=c(Cu2+)C(OH-)2公式既得结果
(5)见答案
本题难度:一般