| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《盐类水解的原理》答题技巧(2019年最新版)(四)
参考答案:A 本题解析:Na2CO3溶液中CO32?水解,NaHCO3溶液中HCO3?水解,CO32?的水解程度大于HCO3?的水解,所以0.1 mol / L Na2CO3溶液的pH大,故A项正确。 本题难度:一般 3、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是 |
参考答案:C
本题解析:由溶液 pH计算表达式可得,c(H+)=10-pHmol/L,则pH=4的醋酸中c(H+)=10-4 mol?L-1,A项错误;小苏打的化学式是NaHCO3,属于钠盐、酸式盐,在水中能完全电离,即NaHCO3="=" Na++HCO3-,钠离子不能水解,而HCO3-不仅少部分水解生成碳酸,还有少部分HCO3-电离出碳酸根离子,即HCO3-+H2O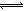 H2CO3+OH-、HCO3-
H2CO3+OH-、HCO3-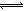 H++CO32-,且其水解程度大于电离程度,则饱和小苏打溶液中:c(Na+)>c(HCO3-),B项错误;饱和食盐水中溶质为NaCl、溶剂为H2O,前者全部电离为Na+、Cl-,后者部分电离为OH-、H+,根据电荷守恒原理可得:c(Na+)+ c(H+)= c(Cl-)+c(OH-),C项正确;25℃时Kw= c(H+)?c(OH-)=1.0×10-14,水的电离是吸热反应,升高温度能促使H2O
H++CO32-,且其水解程度大于电离程度,则饱和小苏打溶液中:c(Na+)>c(HCO3-),B项错误;饱和食盐水中溶质为NaCl、溶剂为H2O,前者全部电离为Na+、Cl-,后者部分电离为OH-、H+,根据电荷守恒原理可得:c(Na+)+ c(H+)= c(Cl-)+c(OH-),C项正确;25℃时Kw= c(H+)?c(OH-)=1.0×10-14,水的电离是吸热反应,升高温度能促使H2O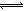 H++OH-的电离平衡右移,则50℃时Kw= c(H+)?c(OH-)>1.0×10-14,pH=12的纯碱溶液中c(H+)=10-pHmol/L=10-12mol/L,c(OH-)= Kw/ c(H+)>1.0×10-2molL-1,D项错误。
H++OH-的电离平衡右移,则50℃时Kw= c(H+)?c(OH-)>1.0×10-14,pH=12的纯碱溶液中c(H+)=10-pHmol/L=10-12mol/L,c(OH-)= Kw/ c(H+)>1.0×10-2molL-1,D项错误。
【91考试网考点定位】本题考查考生对溶液pH的了解;考查考生对盐类水解、弱电解质在水中的电离的了解;考查考生对水溶液中离子浓度大小的比较;考查考生对水的电离平衡和离子积常数的了解;考查考生对温度与平衡常数大小关系的了解。
本91考试网解析为91考试网名师91考试网解析团队原创,授权91考试网独家使用,如有盗用,依法追责!
二、双项选择题:本大题共2小题,每小题6分,共12分。在每小题给出四个选项中,有两个选项符合题目要求,全部选对的得6分,只选1个且正确的得3分,有选错或不答的得0分。
本题难度:一般
4、选择题 某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变
④c(H+)·c(OH)-的积不变⑤c(H+)一定增大
A.①
B.①⑤
C.①②④
D.①③
参考答案:B
本题解析:氧化钙能和水反应生成氢氧化钙,同时放热。由于氢氧化钙是饱和溶液,且氢氧化钙的溶解度随温度的升高而降低,所以溶液中会析出晶体。溶解度降低,浓度减小,因此碱性降低,所以氢离子浓度增大答案选B。
本题难度:一般
5、填空题 (6分)(用化学用语及必要的文字回答)
(1) 配制碳酸钾溶液要加少量的__ ___,原因是____ 。
(2)FeCl3溶液蒸干并灼烧得到的固体是___ __,原因是______ 。
参考答案:(1)__KOH___ (2)___Fe2O3_
本题解析:(1)K2CO3在水溶液里发生电离,电离出的CO32-发生水解,使溶液呈碱性,而加入少量KOH意在利用同离子效应,使得KOH电离出的OH-抑制CO32-的水解。
(2)FeCl3溶液中Fe3+发生水解,水解生成氢氧化铁和氯化氢,在持续加热的情况下,HCl不断挥发,平衡不断正向移动,最后剩余氢氧化铁,再灼烧,氢氧化铁分解失水,最后只剩Fe2O3固体。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《物质的量》.. | |